题目内容
10.下列有关电解质溶液的说法正确的是( )| A. | 向盐酸中加入氨水至中性,溶液中$\frac{C(N{{H}_{4}}^{+})}{C(C{l}^{-})}$>1 | |
| B. | 向0.1mol/L CH3COOH溶液中加入少量水,溶液中$\frac{C({H}^{+})}{C(C{H}_{3}COOH)}$增大 | |
| C. | 在蒸馏水中滴加浓H2SO4,Kw不变 | |
| D. | 将CH3COONa溶液从20℃升温至30℃,溶液中$\frac{C(C{H}_{3}CO{O}^{-})}{C(C{H}_{3}COOH)•C(O{H}^{-})}$增大 |
分析 A.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)得到c(NH4+)=c(Cl-);
B.向0.1mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少;
C.溶液中离子积常数随温度变化;
D.醋酸钠溶液中醋酸根离子水解溶液显碱性,水解过程吸热,升温平衡正向进行,水解平衡常数增大;
解答 解:A.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)得到c(NH4+)=c(Cl-),$\frac{c(N{{H}_{4}}^{+})}{c(C{l}^{-})}$=1,故A错误;
B.向0.1mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少,溶液中$\frac{C({H}^{+})}{C(C{H}_{3}COOH)}$增大,故B正确;
C.溶液中离子积常数随温度变化,在蒸馏水中滴加浓H2SO4,浓硫酸溶解溶液温度升高,促进水的电离,Kw增大,故C错误;
D.醋酸钠溶液中醋酸根离子水解溶液显碱性,水解过程吸热,升温平衡正向进行,水解平衡常数增大,Kh=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$增大,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$减小,故D错误;
故选B.
点评 本题考查弱电解质电离平衡、水解平衡影响因素分析判断,主要是水的电离平衡中离子积常数的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
20.如表分散系中存在的粒子种类不正确的是( )
| 选项 | 分散系 | 存在粒子 |
| A | 氯水 | Cl2、HClO、H2O、Cl-、ClO-、H+、OH- |
| B | 明矾溶液 | K+、Fe3+、SO42-、H2O、H+、OH- |
| C | 碳酸钠溶液 | Na+、CO32-、HCO3-、H2CO3、H2O、H+、OH- |
| D | 氯化钠与溴化钾混合溶液 | K+、Na+、Cl-、Br-、H2O、H+、OH- |
| A. | A | B. | B | C. | C | D. | D |
1.化学无处不在,下列有关说法不正确的是( )
| A. | 纽扣银锌电池体型小,含有害物质少,用后可以随意丢弃 | |
| B. | 采用外加电流的阴极保护法可防止钢铁锈蚀 | |
| C. | 裂化汽油与直馏汽油的成分不完全相同 | |
| D. | 色谱法可用于分离、提纯有机物 |
18.下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al ⑥NaHSO4⑦AlCl3⑧Na2SiO3.
①NaHCO3②(NH4)2SO3③Al2O3④Al(OH)3⑤Al ⑥NaHSO4⑦AlCl3⑧Na2SiO3.
| A. | 全部 | B. | ①②③④⑤ | C. | ③④⑤⑥⑦ | D. | ②③④⑤⑧ |
2.化学与环境、材料等关系密切,下列说法正确的是( )
| A. | 计算机芯片的主要成分是二氧化硅 | |
| B. | 碘盐能防治碘缺乏病,但必须科学合理摄入 | |
| C. | 用电镀废水直接灌溉农田,可提高水资源的利用率 | |
| D. | CO2是导致酸雨发生的主要原因 |
19.下列说法正确是的( )
| A. | CH2(OH)CH2OH和乙醇是同系物 | |
| B. | 正丁烷与异丁烷互为同分异构体,金刚石与石墨也是 | |
| C. | 丙烯与水加成有2种同分异构体产物 | |
| D. | SiO2既可以和NaOH溶液反应,又可以与氢氟酸反应,所以其为两性氧化物 |
14.X、Y、Z、M、N代表五种金属,它们之间有以下反应:
①水溶液中:X+Y2+=X2++Y
②只有Z能与冷水发生如下反应:Z+2H2O(冷水)=Z(OH)2+H2↑
③M、N分别为电极,与N盐组成原电池,电流由N流向M;
④Y、M为电极,稀硫酸作电解质溶液组成原电池,M电极上有气泡产生.
则这五种金属的活泼性由强到弱的顺序是( )
①水溶液中:X+Y2+=X2++Y
②只有Z能与冷水发生如下反应:Z+2H2O(冷水)=Z(OH)2+H2↑
③M、N分别为电极,与N盐组成原电池,电流由N流向M;
④Y、M为电极,稀硫酸作电解质溶液组成原电池,M电极上有气泡产生.
则这五种金属的活泼性由强到弱的顺序是( )
| A. | Z>X>Y>N>M | B. | Z>Y>X>M>N | C. | Z>X>Y>M>N | D. | Y>M>N>Z>X |


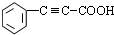 .
.
 、
、 .
. 的合成路线,其它无机试剂任选.
的合成路线,其它无机试剂任选.