题目内容
用双线桥标出下列反应中的电子转移的方向及数目,并指出氧化剂和还原剂
(1)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
氧化剂是 ,还原剂是 ,
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
氧化剂是 ,还原剂是 .
(1)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
氧化剂是
(2)2FeCl3+2HI=2FeCl2+2HCl+I2
氧化剂是
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)Cu元素的化合价升高,N元素的化合价降低,转移6e-;
(2)Fe元素的化合价降低,I元素的化合价升高,该反应转移2e-,以此来解答.
(2)Fe元素的化合价降低,I元素的化合价升高,该反应转移2e-,以此来解答.
解答:
解:(1)该反应中Cu元素化合价由0价变为+2价、Cu为还原剂,部分N元素化合价由+5价变为+2价,则HNO3为氧化剂,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;HNO3;Cu;
;HNO3;Cu;
(2)Fe元素化合价从+3价变化为+2价得到电子,则FeCl3为氧化剂;碘元素化合价从-1价变化为0价,则HI为还原剂,用双线桥标注电子转移为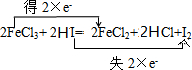 ,
,
故答案为: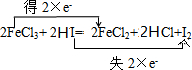 ;FeCl3;HI.
;FeCl3;HI.
用双线桥标出该反应电子转移的方向和数目为
 ,
,故答案为:
 ;HNO3;Cu;
;HNO3;Cu;(2)Fe元素化合价从+3价变化为+2价得到电子,则FeCl3为氧化剂;碘元素化合价从-1价变化为0价,则HI为还原剂,用双线桥标注电子转移为
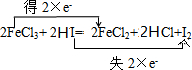 ,
,故答案为:
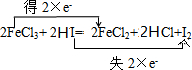 ;FeCl3;HI.
;FeCl3;HI.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子表示方法的考查,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案
相关题目
下列关于原电池的叙述正确的是( )
| A、原电池是化学能转变为电能的装置 |
| B、构成原电池的正极和负极必须是两种不同的金属 |
| C、在原电池中,电子流出的一极是负极,该电极被还原 |
| D、原电池放电时,电流的方向是从负极到正极 |
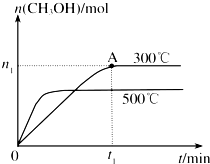 甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)
甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g) 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.  A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
A、B、C、D为短周期元素,A元素的原子价电子排布为ns2np2,B元素原子的最外层子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题: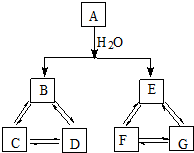 有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知:
有A、B、C、D、E、F、G七种常见物质,它们满足下图所示转化关系.已知: