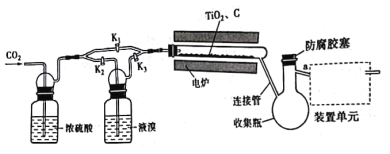
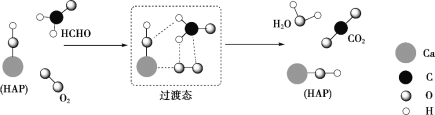
题目内容
【题目】某2L溶液中可能含有H+、![]() 、Mg2+、Al3+、Fe3+、
、Mg2+、Al3+、Fe3+、![]() 、
、![]() 、
、![]() 中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
中的几种。①若加入锌粒,产生无色无味无毒的气体②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是

A.溶液中的阳离子只有H+、Mg2+、Al3+
B.溶液中c(![]() )=0.2mol L-1
)=0.2mol L-1
C.溶液中一定不含![]() 可能含
可能含![]() 和
和![]()
D.三种离子的物质的量之比n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
【答案】D
【解析】
若加入锌粒,产生无色无味无毒的气体,说明气体是氢气,因此溶液显酸性,则![]() 和
和![]() 不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在
不能大量共存;加入NaOH溶液,产生白色沉淀,说明不存在铁离子;根据产生的沉淀量与加入NaOH的物质的量之间的关系图可知,溶液中一定含有Mg2+、Al3+;又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液中还存在![]() ,由于溶液中还必须存在阴离子,所以一定还有
,由于溶液中还必须存在阴离子,所以一定还有![]() ,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(
,结合图象中各阶段消耗的氢氧化钠,计算溶液中n(H+)、n(Mg2+)、n(Al3+)、n(![]() ),据此解答。
),据此解答。
由图象可知,第一阶段为氢离子与氢氧化钠反应,消耗氢氧化钠为0.1mol,则n(H+)=0.1mol;第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7mol0.5mol=0.2mol,则n(![]() )=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol0.1mol=0.4mol,则n(Mg2+)=
)=0.2mol;最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8mol0.7mol=0.1mol,则n[Al(OH)3]=0.1mol,根据铝元素守恒可知n(Al3+)=0.1mol;第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5mol0.1mol=0.4mol,则n(Mg2+)=![]() =0.05mol,
=0.05mol,
A.由上述分析可知,溶液中的阳离子只有H+、Mg2+、Al3+、![]() ,故A错误;
,故A错误;
B.由上述分析可知,溶液中n(![]() )=0.2mol,c(
)=0.2mol,c(![]() )=0.1mol L-1,故B错误;
)=0.1mol L-1,故B错误;
C.由上述分析可知,溶液中一定不含![]() 、
、![]() ,一定含有
,一定含有![]() ,故C错误;
,故C错误;
D.由上述分析可知,溶液中n(H+):n(Al3+):n(Mg2+)=0.1mol:0.1mol:0.05mol=2:2:1,故D正确;
故选:D。

 阅读快车系列答案
阅读快车系列答案【题目】在一定条件下,将A和B各![]() 充入10L的恒容密闭容器中,发生如下反应:
充入10L的恒容密闭容器中,发生如下反应:![]() ;
;![]() 。反应过程中测定的数据如表,则下列说法正确的是
。反应过程中测定的数据如表,则下列说法正确的是
| 0 | 2 | 4 | 7 | 9 |
|
|
|
|
|
|
A.其他条件不变,向平衡体系中再充入![]() A,再达平衡时,B的转化率增大
A,再达平衡时,B的转化率增大
B.其他条件不变,降低温度,反应达到新平衡前v![]() 逆
逆![]()
![]() 正
正![]()
C.其他条件不变,起始时向容器中充入各![]() A和B,平衡时
A和B,平衡时![]()
D.反应前2min的平均速率![]()
![]()
【题目】某温度下,反应2CH3OH(g)![]() CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
CH3OCH3(g) + H2O(g)的平衡常数为400。此温度下,在容积一定的密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度为表中相应的数据。下列说法正确的是
物质 | CH3OH | CH3OCH3 | H2O |
浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
A.CH3OH的起始浓度为1.04 mol/LB.平衡时CH3OH的浓度为0.04 mol/L
C.此时逆反应速率大于正反应速率D.平衡时CH3OH的转化率小于80%