题目内容
18.从①乙醇②二氧化硫③氯气④氢氧化铝⑤硝酸银⑥二氧化碳6种物质中,选出适当的物质填空(填序号)(1)注射时用于皮肤杀菌、消毒的物质主要成分是①;
(2)可用于制漂白粉的物质是③;
(3)与盐酸反应生成白色沉淀的物质是⑤;
(4)能产生温室效应的物质是⑥;
(5)既能与酸反应又能与碱反应,生成盐和水的物质是④;
(6)形成酸雨的主要物质是②.
分析 依据物质性质和应用分析,乙醇消毒杀菌,二氧化硫是形成酸雨的气体,氯与气和氢氧化钙反应生成次氯酸钙和氯化钙,氢氧化铝属于两性氢氧化物,硝酸银和含氯离子的溶液反应生成白色沉淀,二氧化碳是温室气体.
解答 解:乙醇消毒杀菌,二氧化硫是形成酸雨的气体,氯与气和氢氧化钙反应生成次氯酸钙和氯化钙,氢氧化铝属于两性氢氧化物,硝酸银和含氯离子的溶液反应生成白色沉淀,二氧化碳是温室气体,
(1)注射时用于皮肤杀菌、消毒的物质主要成分是乙醇,可以使蛋白质发生变性,故答案为:①;
(2)氯与气和氢氧化钙反应生成次氯酸钙和氯化钙,工业上利用此反应制备漂白粉,故答案为:③;
(3)硝酸银与盐酸反应生成白色沉淀,Ag++Cl-=AgCl↓,故答案为:⑤;
(4)能产生温室效应的物质是二氧化碳,故答案为:⑥;
(5)既能与酸反应又能与碱反应,生成盐和水的物质是氢氧化铝,故答案为:④;
(6)形成酸雨的主要物质是二氧化硫,故答案为:②.
点评 本题考查了物质性质和应用,注意知识的熟练掌握和积累,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.实验时,不慎把浓NaOH溶液洒在皮肤上,正确的处理方法是( )
| A. | 用水冲洗,再涂上硼酸溶液 | |
| B. | 用稀硫酸溶液中和,再用水冲洗 | |
| C. | 用布擦去NaOH后,用稀硫酸溶液冲洗 | |
| D. | 用布擦去硫酸后,用大量水冲洗,再用3%-5%的碳酸氢钠溶液冲洗 |
9.质量分数为26%的氨水的密度是0.92g/cm3,质量分数为6%的氨水的密度是0.98g/cm3,将这两种氨水等体积混合,混合后所得氨水的质量分数( )
| A. | 等于16% | B. | 小于16% | C. | 大于16% | D. | 无法判断 |
6.下列关于铵盐的叙述中正确的是( )
| A. | .所有铵盐都溶于水 | |
| B. | 铵态氮肥与草木灰混合使用肥效更好 | |
| C. | .铵盐受热分解都会产生氨气 | |
| D. | .铵盐都能与碱反应,都不能与酸反应 |
13.下列物质的化学式中,具有极性键的离子化合物是( )
| A. | Na2O2 | B. | MgCl2 | C. | NaOH | D. | HCl |
3.盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子.合理利用资源和保护环境是我市可持续发展的重要保证.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
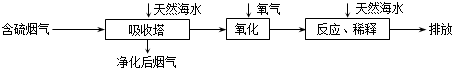
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.
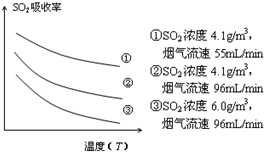
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染.
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(任写一个).
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示.

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:降低含硫烟气温度(或流速).
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-(任写一个化学方程式或离子方程式).氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染.

 .
.