题目内容
下列关于物质性质的说法正确的是( )
| A、二氧化硅既溶于强酸,又溶于强碱 |
| B、铁在纯氧中的燃烧产物是红棕色固体 |
| C、盐酸滴加到水玻璃中,可以产生白色胶状物质 |
| D、铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
考点:硅和二氧化硅,铁的化学性质,铜金属及其重要化合物的主要性质
专题:碳族元素,几种重要的金属及其化合物
分析:A.二氧化硅能溶于强碱但不溶于强酸;
B.铁在纯氧中燃烧生成黑色的四氧化三铁;
C.盐酸和硅酸钠反应生成白色硅酸沉淀;
D.Cu和浓硝酸反应生成硝酸铜.
B.铁在纯氧中燃烧生成黑色的四氧化三铁;
C.盐酸和硅酸钠反应生成白色硅酸沉淀;
D.Cu和浓硝酸反应生成硝酸铜.
解答:
解:A.二氧化硅属于酸性氧化物,能溶于强碱生成硅酸盐和水,不溶于强酸,但能和HF反应,故A错误;
B.铁在纯氧中燃烧生成黑色的四氧化三铁,反应方程式为3Fe+2O2
Fe3O4,故B错误;
C.盐酸和硅酸钠反应生成白色硅酸沉淀,反应方程式为2HCl+Na2SiO3=H2SiO3↓+2NaCl,故C正确;
D.Cu和浓硝酸反应生成硝酸铜,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑,故D错误;
故选C.
B.铁在纯氧中燃烧生成黑色的四氧化三铁,反应方程式为3Fe+2O2
| ||
C.盐酸和硅酸钠反应生成白色硅酸沉淀,反应方程式为2HCl+Na2SiO3=H2SiO3↓+2NaCl,故C正确;
D.Cu和浓硝酸反应生成硝酸铜,反应方程式为Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑,故D错误;
故选C.
点评:本题考查了物质间的反应,明确物质的性质是解本题关键,根据物质的性质分析解答,知道常温下盛放浓硝酸和浓硫酸容器的材料,题目难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、由H原子形成1mol H-H键要吸收热量 |
| B、所有燃烧反应都是放热反应 |
| C、据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| D、凡经加热而发生的化学反应都是吸热反应 |
下列叙述不正确的是( )
| A、NH3易液化,液氨常用作制冷剂 |
| B、稀HNO3和活泼金属反应时很难得到氢气 |
| C、与金属反应时,稀HNO3可能被还原为更低价态,故稀HNO3氧化性强于浓HNO3 |
| D、铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉处 |
下列叙述正确的是( )
| A、1 mol CO2 的质量为44g/mol |
| B、NA个CO2的质量与CO2的相对分子质量在数值上相同 |
| C、CO2的摩尔质量为44g/mol |
| D、CO2的摩尔质量等于CO2的相对分子质量 |
W、X、Y、Z是短周期中的常见元素,其部分性质如下表,下列说法不正确的是( )
| W | 单质是淡黄色固体 | ||
| X | 第三周期原子半径最小的金属 | ||
| Y | 单质不能将比它不活泼的金属从盐溶液中置换出来 | ||
| Z | 原子最外层电子数是电子总数的
|
| A、Y、X、W的原子半径依次减小,其单核离子的半径按X、Y、W的顺序依次增大 |
| B、W、X、Y的最高价氧化物的水化物之间可以两两反应 |
| C、Y的氧化物与Z的最高价氧化物反应一定是氧化还原反应 |
| D、W、Z、X、Y的最高正价依次降低 |
已知将液溴滴入热的NaOH浓溶液中,发生如下氧化还原反应:3Br2+6NaOH=5NaBr+NaBrO3+3H2O,氧化剂和还原剂的物质的量之比正确的是( )
| A、.1:2 | B、.1:5 |
| C、.5:1 | D、2:1 |
下列实验中主要不是从安全因素考虑的是( )
| A、酒精灯在不使用时,必须盖上灯帽 | ||
| B、不能直接用嘴吹灭酒精灯 | ||
C、酒精少于
| ||
| D、不能用酒精灯点燃另一酒精灯 |
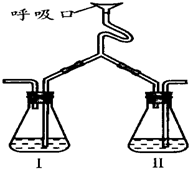 为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )
为验证人体呼出气体中含有的CO2不是来自空气,而是人体代谢作用产生的.某学校学生课外活动小组设计了如图所示装置(备注:通过呼吸口慢吸慢呼来实现),你认为该装置应选用的试剂是( )