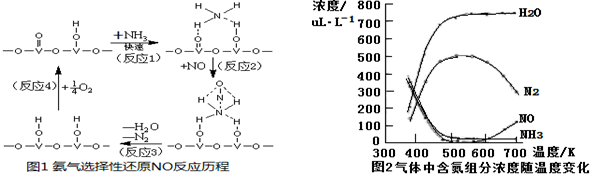
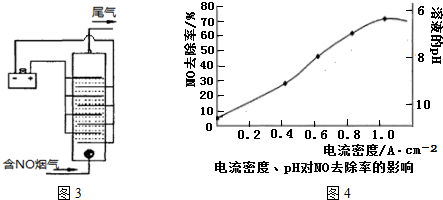
题目内容
3.已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)(1)写出该反应的化学平衡常数表达式:K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}{O}_{\;})}$.
(2)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为40%;K值为1.
(3)830K时,若只将起始时C(H2O)改为6mol/L,则水蒸气的转化率为25%.
分析 (1)K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 3 0 0
转化1.2 1.2 1.2 1.2
平衡时0.8 1.8 1.2 1.2
结合转化率=$\frac{转化的量}{开始的量}$×100%、平衡浓度计算K;
(3)设转化的水蒸气为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 6 0 0
转化 x x x x
平衡时2-x 6-x x x
K=$\frac{x×x}{(2-x)(6-x)}$,以此来解答.
解答 解:(1)K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}{O}_{\;})}$,故答案为:K=$\frac{c(C{O}_{2})c({H}_{2})}{c(CO)c({H}_{2}{O}_{\;})}$;
(2)CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 3 0 0
转化1.2 1.2 1.2 1.2
平衡时0.8 1.8 1.2 1.2
水蒸气的转化率为=$\frac{转化的量}{开始的量}$×100%=$\frac{1.2mol/L}{3mol/L}$×100%=40%;
K=$\frac{1.2×1.2}{0.8×1.8}$=1,
故答案为:40%;1;
(3)设转化的水蒸气为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 2 6 0 0
转化 x x x x
平衡时2-x 6-x x x
K=$\frac{x×x}{(2-x)(6-x)}$=1,解得x=1.5mol/L,
水蒸气的转化率为$\frac{1.5}{6}$×100%=25%,
故答案为:25%.
点评 本题考查化学平衡的计算,为高频考点,把握K的意义及K只与温度有关为解答的关键,侧重分析与计算能力的考查,注意三段法计算格式的应用,题目难度不大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 左盘高 | B. | 右盘高 | C. | 仍保持平衡 | D. | 不能确定 |
| A. | 分子式为C2H4O2的有机物不一定有酸性 | |
| B. | 当物质中的化学键发生断裂时,一定发生化学变化 | |
| C. | 等质量的Al分别按a、b两种途径完全转化,途径a比途径b产生的H2多 途径a:Al$\stackrel{HCl}{→}$H2 途径b:Al$\stackrel{Fe_{2}O_{3}}{→}$Fe$\stackrel{HCl}{→}$H2 | |
| D. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 |
| A. | 平衡时,v正(O2)=v逆(O2)=0必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 在同一段时间范围内,用上述四种物质NH3、O2、NO、H2O的变化表示正反应速率的数值中,v正(H2O)最大 | |
| D. | 若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
2H2(g)+O2(g)═2H2O(g)△H=-Q2 kJ/mol;
H2O(g)═H2O(l)△H=-Q3kJ/mol
(1)C2H2的燃烧热为Q1/2kJ/mol
(2)写出H2燃烧热的热化学方程式H2(g)+1/2O2(g)═H2O(l)△H=-(1/2Q2+Q3)kJ/mol
(3)常温下,取体积比为4:1的C2H2和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为(2Q1+0.5Q2+Q3)kJ
(4)甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2、H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)?CH3(OH)(g)△H1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
已知反应①中相关的化学键键能数据如下:
| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
| A. | 向装置中通入氮气且保持体积不变 | |
| B. | 向装置中通入稍过量氧气且保持体积不变 | |
| C. | 添加更多的催化剂 | |
| D. | 降低温度,及时转移SO3 |
| A. | 按系统命名法,化合物 的名称为:2,6-二甲基-5-乙基庚烷 的名称为:2,6-二甲基-5-乙基庚烷 | |
| B. | 丙氨酸和苯丙氨酸脱水,最多可生成3种二肽 | |
| C. | 大气污染物氟利昂-12的化学式是CF2Cl2具有正四面体结构 | |
| D. | 三硝酸甘油酯的分子式为C3H5N3O9 |
| A. | 雾屑于胶体,能产生丁达尔现象 | |
| B. | 大雾的形成与汽车的尾气排放没有关系 | |
| C. | 持续大雾天气给农业生产、交通运输等带来很大的影响 | |
| D. | 空气中悬浮的细小颗粒物严重危害人体健康 |