题目内容
化学与生产、生活密切相关,下列说法正确的是( )
| A、小苏打用于治疗胃溃疡病人的胃酸过多症 |
| B、工厂常用的静电除尘方法与胶体性质无关 |
| C、FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
| D、电解从海水中得到的氯化钠溶液可获得金属钠 |
考点:胶体的应用,金属冶炼的一般原理,钠的重要化合物
专题:
分析:A.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗;
B.电泳是胶体的一种性质;
C.金属铜可以和三价铁离子反应生成亚铁离子和铜离子;
D.电解食盐水会获得氢氧化钠、氢气和氯气.
B.电泳是胶体的一种性质;
C.金属铜可以和三价铁离子反应生成亚铁离子和铜离子;
D.电解食盐水会获得氢氧化钠、氢气和氯气.
解答:
解:A.小苏打与胃酸中的盐酸反应生成氯化钠、水和二氧化碳气体,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,患胃溃疡的病人,为防止胃壁穿孔,不能服用小苏打来治疗,因为反应产生的二氧化碳气体会造成胃部气胀,易造成胃穿孔,故A错误;
B.静电除尘对胶体电泳性质的利用,故B错误;
C.FeCl3溶液能与Cu反应,生成氯化亚铁和氯化铜,可用于蚀刻印刷电路板,故C正确;
D.电解食盐水会获得氢氧化钠、氢气和氯气,电解熔融的氯化钠可以获得金属钠,故D错误.
故选C.
B.静电除尘对胶体电泳性质的利用,故B错误;
C.FeCl3溶液能与Cu反应,生成氯化亚铁和氯化铜,可用于蚀刻印刷电路板,故C正确;
D.电解食盐水会获得氢氧化钠、氢气和氯气,电解熔融的氯化钠可以获得金属钠,故D错误.
故选C.
点评:本题考查了元素以及化合物的性质以及应用是化学的考查热点,注意知识的归纳和整理是关键,较简单.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列说法中,正确的是( )
| A、硅胶的主要成分是硅酸钠 |
| B、明矾和氯化铁都可作净水剂 |
| C、发酵粉的主要成分是碳酸钠 |
| D、光导纤维的主要材料是晶体硅 |
一定温度下,有可逆反应:2A(g)+2B(g)?C(g)+3D(g)△H<0.现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1).关于两容器中反应的说法正确的是( )
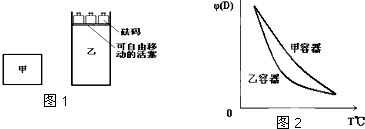

| A、甲容器中的反应先达到化学平衡状态 |
| B、两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 |
| C、两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同 |
| D、在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等 |
下列描述中正确的是( )
| A、HCl和NaOH反应的中和热△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ?mol-1 |
| B、CO(g)的燃烧热是283.0 kJ?mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ?mol-1 |
| C、牺牲阳极阴极保护法是应用电解原理防止金属的腐蚀 |
| D、用洁净玻璃棒蘸取某溶液点在湿润的pH试纸上,与标准比色卡对比即可测定该溶液pH |
下列物质中,碱性最强的是( )
| A、Mg(OH)2 |
| B、NaOH |
| C、KOH |
| D、LiOH |
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515.20.2g该样品与100mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为( )
| A、78 | B、140 |
| C、156 | D、172 |
下列有关实验操作的说法错误的是( )
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、滴定时,左手控制滴定管活塞,右手持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
