题目内容
A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色.取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少.组成这五种物质的离子见下表(各物质所含的离子均不相同)
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,有沉淀继续加入B溶液至过量时,沉淀会部分溶解.
(1)据此推断:A ;B ;C ;D ;E .(写化学式)
(2)写出下列反应的离子方程式.
①过量的B溶液与C溶液: .
②过量的B溶液与D溶液(已知偏铝酸钡易溶于水): .
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ | ||||
| 阴离子 | OH- Cl- C
|
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,有沉淀继续加入B溶液至过量时,沉淀会部分溶解.
(1)据此推断:A
(2)写出下列反应的离子方程式.
①过量的B溶液与C溶液:
②过量的B溶液与D溶液(已知偏铝酸钡易溶于水):
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:A、B、C、D、E均为可溶于水的固体,结合离子性质判断CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;
若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会部分消失现象,所以推断D为 Al2(SO4)3;E为FeCl3.
①A溶液分别其他四种溶液反应,均有沉淀;证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;
若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会部分消失现象,所以推断D为 Al2(SO4)3;E为FeCl3.
解答:
解:(1)A、B、C、D、E、均为可溶于水的固体,结合离子性质和离子共存的特征分析判断,CO32-只能和Na+结合为Na2CO3,氢氧根离子只能和Ba2+结合为Ba(OH)2;所得的溶液只有E溶液有颜色说明E溶液中含Fe3+,取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少,说明加热分解说明是含有HCO3-离子,依据离子共存可知碳酸氢根离子只能和镁离子形成溶于水的化合物,即C为Mg(HCO3)2;
①A溶液分别其他四种溶液反应,均有沉淀,证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;D可能为AlCl3 或Al2(SO4)3;E则可能为Fe2(SO4)3 或FeCl3;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会部分消失现象,所以推断D为 Al2(SO4)3,E为FeCl3,
故答案为:Na2CO3;Ba(OH)2;Mg(HCO3)2 ; Al2(SO4)3;FeCl3;
(2)①B为Ba(OH)2,C为Mg(HCO3)2 ,过量的Ba(OH)2和Mg(HCO3)2 ,反应生成碳酸钡沉淀和氢氧化镁沉淀,反应的离子方程式为2Ba2++4OH-+Mg2++2HCO3-=2H2O+2BaCO3↓+Mg(OH)2↓,故答案为:2Ba2++4OH-+Mg2++2HCO3-=2H2O+2BaCO3↓+Mg(OH)2↓;
②过量Ba(OH)2和Al2(SO4)3反应生成硫酸钡沉淀和偏铝酸钡和水,反应的离子方程式为3 Ba2++8 OH-+2Al3++3SO42-=3BaSO4↓+2AlO2-+4H2O,
故答案为:3Ba2++8 OH-+2Al3++3SO42-=3BaSO4↓+2AlO2-+4H2O.
①A溶液分别其他四种溶液反应,均有沉淀,证明A为Na2CO3;
②B溶液分别与其四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失,证明D溶液中含有Al3+;判断B为Ba(OH)2;D可能为AlCl3 或Al2(SO4)3;E则可能为Fe2(SO4)3 或FeCl3;若D为Al2(SO4)3,加入B为Ba(OH)2,则先有沉淀继续加入B溶液时,沉淀会部分消失现象,所以推断D为 Al2(SO4)3,E为FeCl3,
故答案为:Na2CO3;Ba(OH)2;Mg(HCO3)2 ; Al2(SO4)3;FeCl3;
(2)①B为Ba(OH)2,C为Mg(HCO3)2 ,过量的Ba(OH)2和Mg(HCO3)2 ,反应生成碳酸钡沉淀和氢氧化镁沉淀,反应的离子方程式为2Ba2++4OH-+Mg2++2HCO3-=2H2O+2BaCO3↓+Mg(OH)2↓,故答案为:2Ba2++4OH-+Mg2++2HCO3-=2H2O+2BaCO3↓+Mg(OH)2↓;
②过量Ba(OH)2和Al2(SO4)3反应生成硫酸钡沉淀和偏铝酸钡和水,反应的离子方程式为3 Ba2++8 OH-+2Al3++3SO42-=3BaSO4↓+2AlO2-+4H2O,
故答案为:3Ba2++8 OH-+2Al3++3SO42-=3BaSO4↓+2AlO2-+4H2O.
点评:本题考查了物质检验的方法,物质性质的分析判断,反应现象的综合应用,熟知物质性质,理解离子共存是解题关键.写离子方程式时,要注意量不同,反应产物不同.

练习册系列答案
相关题目
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则参加反应的Cr3+与PbO2的个数之比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
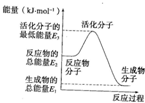 已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1
已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ?mol-1.
③N2(g)+3H2(g)═2NH3(g)△H2=-92.4kJ?mol-1
下列说法正确的是( )
| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、H2的燃烧热为△H=-241.8kJ?mol-1 |
| C、由反应③知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为92.4kJ |
| D、反应③中加入催化剂,通过降低反应所需的活化能来增大反应速率 |
7、影片《阿凡达》出现了一种潘多拉星球的宇宙飞船.图表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都是由下表中的元素组成)根据以上信息可推断下列说法正确的是( ) 

| A、e和f组成的化合物可吸收宇航员在宇宙飞船活动舱内产生的由d和f组成的气体 |
| B、活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质 |
| C、c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源 |
| D、若潘多拉星球上存在b,地球上此元素主要以b形式存在,b比b少一个质子 |


 已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.
已知:反应①②③的平衡常数(K)与反应热(△H)的部分相关数据如表所示.