题目内容
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
(Ⅰ)原子半径:A<C<B<E<D
(Ⅱ)原子的最外层电子数:A=D,C=E,A+B=C.
(Ⅲ)原子的核外电子层数:B=C=2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价=2
(Ⅴ)F的单质或合金是用量最大的金属材料.
请回答:
(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式 ;
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式: .
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为 .为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象 ;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中C(SO42-)为: (已知:忽略溶液体积变化.该沉淀的Ksp=2×10-9)
(Ⅰ)原子半径:A<C<B<E<D
(Ⅱ)原子的最外层电子数:A=D,C=E,A+B=C.
(Ⅲ)原子的核外电子层数:B=C=2A
(Ⅳ)B元素的主要化合价:最高正价+最低负价=2
(Ⅴ)F的单质或合金是用量最大的金属材料.
请回答:
(1)甲由A、B两种元素按原子数之比为3:1组成的物质,写出其电子式
(2)写出某含F黑色的磁性氧化物与B最高价氧化物对应水化物的稀溶液反应的离子方程式:
(3)由A、C、E三种元素组成的两种气体化合物,相互反应能生成淡黄色固体的化学反应方程式为
(4)上述元素中A、B、C、E、F的五种元素可形成一种常见复盐,经检测该复盐由三种离子组成且离子个数比为1:1:2,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀;加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,则该复盐的化学式为
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,该溶液中C(SO42-)为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,则F为Fe.
解答:
解:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.原子的核外电子层数:B=C=2A,则A处于第一周期,B、C处于第二周期,则A为H元素;B元素的主要化合价:最高正价+最低负价=2,B处于ⅤA族,则B为N元素;原子的最外层电子数:A=D,C=E,则A、D同主族,C、E同主族,可推知D为Na,最外层电子数A+B=C,则C的最外层电子数=1+5=6,可推知C为O元素、E为S元素;F的单质或合金是用量最大的金属材料,
(1)由H、N两种元素按原子数之比为3:1组成的物质甲为NH3,其电子式为: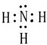 ,故答案为:
,故答案为: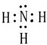 ;
;
(2)含Fe黑色的磁性氧化物为Fe3O4,与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)由H、O、S三种元素组成的两种气体化合物,相互反应能生成淡黄色固体,应是二氧化硫与硫化氢反应生成S与水,化学反应方程式为:SO2+2H2S=3S↓+2H2O,
故答案为:SO2+2H2S=3S↓+2H2O;
(4)上述元素中H、N、O、S、Fe的五种元素可形成一种常见复盐,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,该盐含有SO42-,加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,该盐含有NH4+,经检测该复盐由三种离子组成且离子个数比为1:1:2,由电荷守恒可知,含有Fe3+,则该复盐的化学式为NH4Fe(SO4)2,向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+,
故答案为:NH4Fe(SO4)2;向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,溶液中c(Ba2+)≈
-0.1mol/L×2=0.4mol/L,该溶液中c(SO42-)×c(Ba2+)=2×10-9,故c(Ba2+)=5×10-9mol/L,
故答案为:5×10-9mol/L.
(1)由H、N两种元素按原子数之比为3:1组成的物质甲为NH3,其电子式为:
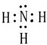 ,故答案为:
,故答案为: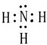 ;
;(2)含Fe黑色的磁性氧化物为Fe3O4,与稀硝酸反应生成硝酸铁、NO与水,反应离子方程式为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O,
故答案为:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O;
(3)由H、O、S三种元素组成的两种气体化合物,相互反应能生成淡黄色固体,应是二氧化硫与硫化氢反应生成S与水,化学反应方程式为:SO2+2H2S=3S↓+2H2O,
故答案为:SO2+2H2S=3S↓+2H2O;
(4)上述元素中H、N、O、S、Fe的五种元素可形成一种常见复盐,向该盐溶液加入酸化的BaCl2溶液,产生白色沉淀,该盐含有SO42-,加入NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的气体,该盐含有NH4+,经检测该复盐由三种离子组成且离子个数比为1:1:2,由电荷守恒可知,含有Fe3+,则该复盐的化学式为NH4Fe(SO4)2,向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+,
故答案为:NH4Fe(SO4)2;向该盐溶液中加入硫氰化钾溶液,溶液变红则含有Fe3+;
(5)将上述复盐配成0.1L 0.1mol/L的溶液,向其中加入0.06mol的BaCl2固体完全反应后,溶液中c(Ba2+)≈
| 0.06mol |
| 0.1L |
故答案为:5×10-9mol/L.
点评:本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生对知识的迁移应用与分析解决问题的能力,难度中等.

练习册系列答案
相关题目
能在溶液中大量共存的一组离子是( )
| A、NH4+、Ca2+、SO42-、CO32- |
| B、Fe3+、H+、I-、HCO3- |
| C、K+、Na+、H+、NO3-、MnO4- |
| D、Al3+、Mg2+、SO42-、CO32- |
下列热化学方程式或离子方程式中,正确的是( )
| A、0.01mol?L-1 NH4Al(SO4)2溶液与0.02mol?L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、一定条件下,将0.5mol N2(g)和1.5mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ?mol-1 |
| C、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
| D、CO(g)的燃烧热是283.0kJ?mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0kJ?mol-1 |
下列说法中正确的是( )
| A、用酒精萃取碘水中的碘 |
| B、少量钠可用铝箔包裹,密封保存在广口瓶中 |
| C、CO2水溶液能导电,是因为CO2是电解质;CaCO3难溶于水,CaCO3是非电解质 |
| D、铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落 |



 如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a值等于
如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a值等于