题目内容
15.工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是A.
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
②500℃时该反应的平衡常数K=1636.3.
(3)恒温恒压,通入3mol SO2 和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是CD.
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于$\frac{2}{9}$.
分析 (1)该反应是一个反应前后气体体积减小的放热反应,欲提高SO2的转化率,则改变条件使平衡向正反应方向移动;
(2)①反应前4分钟生成三氧化硫为8mol,由方程式可知参加反应的氧气为8mol×$\frac{1}{2}$=4mol,根据v=$\frac{△c}{△t}$计算v(O2);
②500℃时将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,6min到达平衡,平衡时产生三氧化硫9.4mol,则:
2SO2(g)+O2 (g)?2SO3 (g)
起始量(mol/L):5 2.5 0
变化量(mol/L):4.7 2.35 4.7
平衡量(mol/L):0.3 0.15 4.7
再根据K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$计算平衡常数;
(3)恒温恒压下,体积之比等于气体物质的量之比,故平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2 (g)?2SO3 (g) 物质的量减小△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 (3+2)-4.5=0.5
平衡量(mol):2 1.5 1
将起始物质的量改为 5mol SO2、3.5mol O2、1mol SO3(g),等效为开始通入6mol SO2 和4mol O2,与第一次平衡时投料比相等,恒温恒压下二者为等效平衡,平衡时同种物质的含量相等、浓度相等,同种组分物质的量第二次平衡时为第一次平衡2倍.
解答 解:(1)A.向装置中充入过量的O2,化学平衡正向移动,会提高二氧化硫转化率,故A正确;
B.正反应为放热反应,升高温度,化学平衡逆向移动,二氧化硫的转化率减小,故B错误;
C.向装置中充入N2,反应各组分浓度不变,化学平衡不会移动,不会提高二氧化硫转化率,故C错误;
D.向装置中充入过量的SO2,二氧化硫转化率降低,故D错误;
故选:A;
(2)①反应前4分钟生成三氧化硫为8mol,由方程式可知参加反应的氧气为8mol×$\frac{1}{2}$=4mol,故反应前4分钟的平均速率v(O2)=$\frac{\frac{4mol}{2L}}{4min}$=0.5mol/(L.min),
故答案为:0.5mol/(L.min);
②500℃时将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,6min到达平衡,平衡时产生三氧化硫9.4mol,则:
2SO2(g)+O2 (g)?2SO3 (g)
起始量(mol/L):5 2.5 0
变化量(mol/L):4.7 2.35 4.7
平衡量(mol/L):0.3 0.15 4.7
则500℃时的平衡常数K=$\frac{4.{7}^{2}}{0.{3}^{3}×0.15}$=1636.3;
故答案为:1636.3;
(3)恒温恒压下,体积之比等于气体物质的量之比,故平衡时混合气体总物质的量为(3mol+2mol)×90%=4.5mol,则:
2SO2(g)+O2 (g)?2SO3 (g) 物质的量减小△n=1
起始量(mol):3 2 0
变化量(mol):1 0.5 1 (3+2)-4.5=0.5
平衡量(mol):2 1.5 1
将起始物质的量改为 5mol SO2、3.5mol O2、1mol SO3(g),等效为开始通入6mol SO2 和4mol O2,与第一次平衡时投料比相等,恒温恒压下二者为等效平衡,平衡时同种物质的含量相等、浓度相等.
A.反应放出的热量为,0.5mol×196.6kJ•mol-1=98.3kJ,故A错误;
B.第一次平衡时二氧化硫转化率为$\frac{1mol}{3mol}$×100%=33.3%,恒温恒压下二者为等效平衡,则第二次平衡后二氧化硫应为2mol×2=4mol,故消耗的二氧化硫为5mol-4mol=1mol,第二次平衡时二氧化硫转化率为$\frac{1mol}{5mol}$×100%,故B错误;
C.两次平衡为等效平衡,两次平衡时的O2体积分数相等,故C正确;
D.由A计算中可知,第一次平衡时三氧化硫体积分数为$\frac{1mol}{4.5mol}$=$\frac{2}{9}$,为等效平衡,平衡时三氧化硫体积分数相等,故D正确,
故选:CD.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、等效平衡等,(3)关键理解等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.

| A. | A、B中的氢的质量分数必相等 | |
| B. | A、B的实验式必相同 | |
| C. | A、B一定是同系物 | |
| D. | A、B可以是烃,也可以是烃的含氧衍生物 |

| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
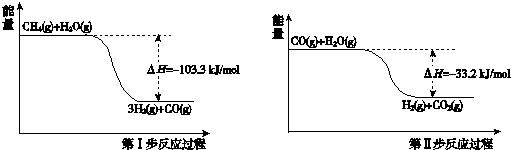
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol.
(2)第II步为可逆反应.在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的起始浓度为3.0mol/L,达到化学平衡状态后,测得CO2的浓度为1.2mol/L,则此反应的平衡常数为1,随着温度升高该反应的化学平衡常数的变化趋势是变小.
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是bc(填序号).
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b.单位时间内断开amol H-H键的同时断开2a mol O-H键
c.反应容器中放出的热量不再变化
d.混合气体的密度不再发生变化
e.混合气体的压强不再发生变化
(4)某温度下,第Ⅱ步反应的平衡常数为K=$\frac{1}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示.下列判断不正确的是CD.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2O)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D.平衡时,乙中H2O的转化率大于25%
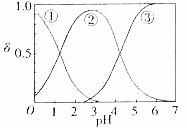 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.