题目内容
14.氟氧酸(HOF)是唯一可分离处固态的“次卤酸”,具有爆炸性.若agHOF中所含分子数与13.44L标准状况下CH4所含分子数相等,a的值为( )| A. | 18.0 | B. | 21.6 | C. | 25.2 | D. | 28.8 |
分析 分子数相等,说明二者的物质的量相等,先根据n=$\frac{V}{{V}_{m}}$计算出标准状况下13.44L甲烷的物质的量,然后根据m=nM计算出HOF的质量.
解答 解:根据N=nNA可知,HOF与CH4的分子数相等,说明二者的物质的量相等,
标准状况下13.44L甲烷的物质的量为:$\frac{13.44L}{22.4L/mol}$=0.6mol,
则需要HOF的质量为:36g/mol×0.6mol=21.6g,则a=21.6,
故选B.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与阿伏伽德罗常数、摩尔质量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
4.下列说法中错误的是( )
①互为同系物的物质通式相同
②分子组成上相差一个或几个CH2原子团的有机物一定是同系物
③若两种烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同系物的两种有机物的物理性质有差异,但化学性质必定相似.
①互为同系物的物质通式相同
②分子组成上相差一个或几个CH2原子团的有机物一定是同系物
③若两种烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同系物的两种有机物的物理性质有差异,但化学性质必定相似.
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | ①②③ |
5.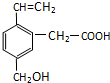 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )
①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能使溴水褪色;
⑥能发加成反应.
 某有机物的结构为如图所示,这种有机物可能具有的性质是( )
某有机物的结构为如图所示,这种有机物可能具有的性质是( )①可以燃烧;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能使溴水褪色;
⑥能发加成反应.
| A. | ①④ | B. | 只有⑥ | C. | 只有⑤ | D. | 全部 |
2.选择下列某种答案的序号,填入表的空格.
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
①同位素 ②同素异形体 ③同分异构体 ④同系物 ⑤同种物质
| 物质名称 | 正丁烷与异丁烷 | 红磷与白磷 | 庚烷与戊烷 | 氯仿与三氯甲烷 | 氕与氘、氚 |
| 相互关系 | ③ | ② | ④ | ⑤ | ① |
9.由CuO、Fe2O3组成的混合物中,两种化合物的物质的量之和是0.2 mol,放入500mL 1.0mol•L-1的盐酸溶液中,混合物恰好完全溶解.则混合物中CuO的物质的量为( )
| A. | 0.05mol | B. | 0.125mol | C. | 0.175mol | D. | 0.025mol |
8.在容积不变的密闭容器中加入1mol N2和3mol H2反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4kJ | |
| B. | 达到平衡后向容器中通入1mol氦气,容器内压强增大,平衡向右移动 | |
| C. | 降低温度和缩小容器体积均可使该反应的平衡常数增大 | |
| D. | 若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
6.由反应物X转化为Y或Z的能量变化如图所示.下列说法正确的是( )
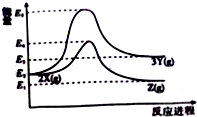

| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 升高温度有利于提高Z的产率 | |
| C. | 由X→Y的反应,增加压强有利于提高X的转化率 | |
| D. | 由X→Z反应的△H<0 |





 为原料通过下列反应来制取有机玻璃:
为原料通过下列反应来制取有机玻璃:

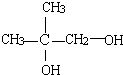 B.
B.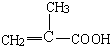 C.
C.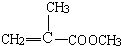
 ;反应②:
;反应②: .
.