题目内容
在一定条件下,反应N2+3H2?2NH3在3L密闭容器中进行,测得2min内,N2的物质的量由2mol减少到0.8mol,则2min内NH3的化学反应速率为( )
| A、1.2 mol?L-1?min-1 |
| B、0.3 mol?L-1?min-1 |
| C、0.6 mol?L-1?min-1 |
| D、0.4 mol?L-1?min-1 |
考点:化学反应速率和化学计量数的关系
专题:化学反应速率专题
分析:根据v=
计算v(N2),再根据速率之比等于其化学计量数之比计算v(NH3).
| ||
| △t |
解答:
解:2min内,N2的物质的量由2mol减少到0.8mol,则v(N2)=
=0.2mol/(L.min),根据速率之比等于其化学计量数之比,v(NH3)=2v(N2)=1.2mol/(L.min),故选A.
| ||
| 2min |
点评:本题考查化学反应速率的有关计算,比较基础,常用计算方法由定义法与化学计量数法,根据情况选择合适的计算方法.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是( )
| A、25℃时,pH均为4的盐酸和NH4I(aq)中,前者KW一定等于后者 |
| B、室温下K(HCN)<K(CH3COOH),说明相同浓度的溶液CH3COONa溶液的pH值一定比NaCN小 |
| C、在500℃、20MPa、5L的密闭容器中进行合成氨的反应,使用催化剂后K值增大 |
| D、2SO2+O2?2SO3平衡后,改变某条件K值不变,SO2的转化率就一定不变 |
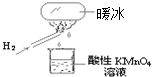 “暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成的.某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色.则下列说法中不正确的是( )| A、在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| B、水凝固形成20℃时的“暖冰”所发生的变化是化学变化 |
| C、该条件下H2燃烧生成了既具有氧化性又具有还原性的物质 |
| D、该条件下H2燃烧的产物中可能含有一定量的H2O2 |
下列反应的离子方程式正确的是( )
A、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
| ||||
| B、向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=AlO2-+2H2O | ||||
| C、硫酸亚铁溶液中加入酸化的双氧水:Fe2++2H++H2O2=Fe3++2H2O | ||||
D、用惰性电极电解MgCl2溶液:2H2O+2Cl-
|
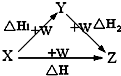 X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,已知焓变:△H=△H1+△H2,则X、Y可能是( )①C、CO
②Na2CO3、NaHCO3
③AlCl3、Al(OH)3
④FeCl2、FeCl3.
| A、①②③④ | B、①③ |
| C、②④ | D、①②③ |
下列实验能达到预期目的是( )
| A、检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B、检验溶液中是否含有Cl-:先滴加硫酸,再滴加AgNO3溶液 |
| C、检验溶液中是否含有SO42-:先滴加稀硫酸,再滴加BaCl2溶液 |
| D、检验溶液中是否含有K+:焰色反应(透过蓝色钴玻璃)观察火焰的颜色 |
下列电离方程式中,正确的是( )
| A、Na2SO4═2Na++SO4-2 |
| B、Al(NO3)3═Al3++3NO3- |
| C、Ba(OH)2═Ba2++(OH-)2 |
| D、CuSO4═Cu2++S6++4O2- |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、100 mL 2.0 mol?L-1 NH4Cl溶液中含有NH4+的数目为0.2NA |
| B、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA |
| C、标准状况下,2.24L庚烷含有的分子数为0.1NA |
| D、常温常压下,NO2与足量H2O反应生成0.1molNO,则转移的电子数为0.2NA |
在密闭容器中进行X2(g)+4Y2(g)?2Z2(g)+3Q2(g)的反应,其中X2、Y2、Z2、Q2的起始浓度分别为:0.1mol/L、0.4mol/L、0.2mol/L、0.3mol/L,反应达到平衡,各物质的浓度不可能为( )
| A、c(X2)=0.15 mol/L |
| B、c(Y2)=0.9 mol/L |
| C、c(Z2)=0.3 mol/L |
| D、c(Q2)=0.6 mol/L |