题目内容
2.(1)0.6mol 的氧气与0.4mol臭氧质量之比为1:1,氧原子个数之比为1:1,标准状况下体积比为3:2.(2)某元素的一种同位素原子X的质量数为a,含N个中子,它与H原子组成HmX分子,在1mol HmX中所含质子的物质的量是a-N+mmol.
分析 (1)利用m=n×M来计算质量及质量之比,分子数之比等于物质的量之比,利用分子的构成来计算氧原子个数之比,根据体积V=nVm来计算体积比;
(2)根据质子数=质量数-中子数计算X原子质子数,确定1molHmX中所含质子的物质的量.
解答 解:(1)氧气与臭氧的质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1,因分子数之比=物质的量之比=标准状况下体积比=0.6mol:0.4mol=3:2,又1个氧分子中含有2个氧原子,1个臭氧分子中含3个氧原子,则氧原子个数之比为0.6mol×2:0.4mol×3=1:1,
故答案为:1:1;1:1;3:2;
(2)某元素的一种同位素X的原子质量数为a,含N个中子,则质子数为(a-N),则每1molHmX分子含有质子数为(a-N+m)mol,故答案为:a-N+m.
点评 本题考查物质的量的计算,难度不大,学生明确质量、摩尔质量、物质的量的关系及物质的构成即可解答.

练习册系列答案
相关题目
17.如表为元素A~G在周期表的位置,请回答有关问题:
(1)G元素原子结构示意图为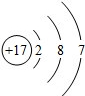 .
.
(2)B元素所形成氢化物的电子式为 .
.
(3)C元素与F元素相比较,氢化物较稳定的是H2O>H2S(填氢化物的化学式).
(4)A、B、C三种元素的原子半径从小到大的顺序是C>N>O(用元素符号表示).
(5)D元素和E元素所形成的最高价氧化物的水化物碱性较强的是NaOH>Al(OH)3(用化学式表示).
(6)B元素的氢化物与G元素的氢化物反应所得生成物是离子(填“离子”或“共价”)化合物.
(7)D元素的过氧化物与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ||||||||
| 二 | A | B | C | |||||
| 三 | D | E | F | G |
 .
.(2)B元素所形成氢化物的电子式为
 .
.(3)C元素与F元素相比较,氢化物较稳定的是H2O>H2S(填氢化物的化学式).
(4)A、B、C三种元素的原子半径从小到大的顺序是C>N>O(用元素符号表示).
(5)D元素和E元素所形成的最高价氧化物的水化物碱性较强的是NaOH>Al(OH)3(用化学式表示).
(6)B元素的氢化物与G元素的氢化物反应所得生成物是离子(填“离子”或“共价”)化合物.
(7)D元素的过氧化物与水反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
13.下列有机物分子中,所有的原子不可能处于同一平面的是( )
| A. | CH2═CH-CN | B. | CH2═CH-CH═CH2 | C. |  -CH═CH2 -CH═CH2 | D. |  |
10.下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | C+H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO+H2 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2F2+2H2O═4HF+O2 |
17.硫代硫酸钠又名大苏打,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.装置如图所示
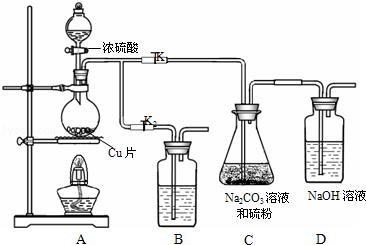
已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
步骤1:如图连接后装置后,打开K1,关闭K2,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱,检查装置A、C、D气密性;
步骤2:加入药品,打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热;
装置B中的药品可选用下列物质中的AC
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D饱和NaHSO3溶液
步骤3:C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时打开K2,关闭K1即停止C中的反应,停止加热.“当C中溶液的pH接近7时即停止C中的反应”的原因是S2O32-+2H+═S↓+H2O+SO2↑.(用离子方程式表示)
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品
(2)Na2S2O3性质的检验,向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,检查反应后的溶液中有硫酸根,写出该反应的离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,得到混合溶液Vml,将其分成4等分,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,相关数据如表所示
部分反应的离子方程式为:①Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;②I2+2S2O32-═S4O62-+2I-
判断达到滴定终点的现象是当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色.
废水中Ba2+的物质的量浓度为0.0024mol/L.

已知:Na2S2O3在酸性溶液中不能稳定存在.
(1)某研究小组设计了制备Na2S2O3•5H2O的装置和部分操作步骤如下.
步骤1:如图连接后装置后,打开K1,关闭K2,将D中导管末端浸入水中,微热烧瓶观察气泡和水柱,检查装置A、C、D气密性;
步骤2:加入药品,打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热;
装置B中的药品可选用下列物质中的AC
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D饱和NaHSO3溶液
步骤3:C中的混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少.当C中溶液的pH接近7时打开K2,关闭K1即停止C中的反应,停止加热.“当C中溶液的pH接近7时即停止C中的反应”的原因是S2O32-+2H+═S↓+H2O+SO2↑.(用离子方程式表示)
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液冷却结晶、过滤、洗涤、烘干,得到产品
(2)Na2S2O3性质的检验,向足量的新制氯水中滴加少量的Na2S2O3溶液,氯水颜色变浅,检查反应后的溶液中有硫酸根,写出该反应的离子方程式S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,得到混合溶液Vml,将其分成4等分,加入淀粉溶液作指示剂,用0.010mol•L-1的Na2S2O3溶液进行滴定,相关数据如表所示
| 编 号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
判断达到滴定终点的现象是当滴入最后一滴Na2S2O3时,溶液蓝色消失且半分钟不变色.
废水中Ba2+的物质的量浓度为0.0024mol/L.
14.NA为阿伏伽德罗常数值下列说法正确的是( )
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
11.下列有关物质用途的说法,不正确的是( )
| A. | 二氧化硫常用来漂白纸浆 | B. | 漂粉精可用于游泳池的消毒 | ||
| C. | 明矾常用于水质消毒 | D. | 氧化铁常用作红色油漆和涂料 |
 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: