题目内容
13.(1)写出NaHSO4在水中的电离方程式NaHSO4═Na++H++SO42-.(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl,用序号表示加入的先后顺序是②③①④或③②①④.
(3)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的.铜屑在此状态下被溶解的化学方程式为2Cu+2H2SO4(稀)+O2 =2CuSO4+2H2O.
(4)利用铜制备CuSO4的另一种方法可用化学方程式表示为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(5)以上两种方法前(填“前”或“后”)者好,原因是若制得1molCuSO4,第一种方法只需1molH2SO4,而第二种方法则要2molH2SO4,而且生成的SO2又造成大气污染.
分析 (1)NaHSO4在水中完全电离生成钠离子、氢离子和硫酸根离子;
(2)盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先除去镁离子或硫酸根离子,再除去钙离子,过滤后,最后加盐酸,据此进行分析;
(3)铜与稀硫酸、氧气反应生成硫酸铜和水;
(4)铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(5)依据生成物性质及消耗硫酸的量解得,从安全、节约、环保等方面进行评价判断选择制备硫酸铜的方法.
解答 解:(1)NaHSO4在水中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式为:NaHSO4═Na++H++SO42-,
故答案为:NaHSO4═Na++H++SO42-;
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,先加入②氢氧化钠溶液除去镁离子或加入③氯化钡溶液除去硫酸根离子,再加入适量①除去除去钙离子,然后过滤除去难溶物,最后加④盐酸,除去过量的碳酸钠、氢氧化钠,所以试剂的顺序为②③①④或 ③②①④,
故答案为:②③①④或③②①④;
(3)将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液的、,反应的化学方程式为:2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+2H2SO4(稀)+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O;
(4)铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(5)能够被空气中的氧气氧化成氧化铜,氧化铜为碱性氧化物,能够与稀硫酸反应生成硫酸铜和水;反应的方程式为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO CuO+H2SO4=CuSO4+H2O;生成1mol硫酸铜消耗1mol硫酸,反应过程中无有毒气体产生;
浓硫酸具有强的氧化性,与铜在加热的条件下发生反应生成硫酸铜、水、二氧化硫,反应的方程式:
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成1mol硫酸铜消耗2mol硫酸,同时生成有毒的气体二氧化硫,所以从环境保护和节约原料角度可知前者更好;
故答案为:前; 若制得1mol CuSO4,第一种方法只需1mol H2SO4,而第二种方法则要2mol H2SO4,而且生成的SO2又造成大气污染;
点评 本题考查了硫酸的性质,题目难度中等,熟悉浓硫酸的强的氧化性是解题关键,注意实验方案评价方法.

 阅读快车系列答案
阅读快车系列答案| A. | 用互滴法鉴别偏铝酸钠和盐酸 | |
| B. | 用CuSO4溶液鉴别NaCl和NaNO3 | |
| C. | 用澄清石灰水鉴别SO2和CO2 | |
| D. | 用AgNO3溶液鉴别NaCl溶液和Na2CO3溶液 |
| A. | 过氧化钠:供氧剂 | B. | 碳酸钠:治疗胃酸过多的一种泻药 | ||
| C. | 氧化铝:耐火坩埚 | D. | 明矾:净水剂 |
| A. | HF溶液与Zn反应放出H2 | B. | 0.1mol/LNaF溶液的pH大于7 | ||
| C. | HF溶液与Na2CO3反应生成CO2 | D. | 0.1mol/LHF溶液可使紫色石蕊变红 |
| A. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀. | |
| B. | 向FeCl3溶液中滴加氨水,产生红褐色沉淀;再加入NaHSO4溶液,沉淀消失 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| D. | 分液时,分液漏斗中下层液体从下口流出,上层液体也从下口放出 |
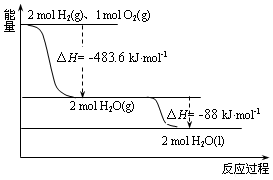
| A. | 氢气的燃烧热△H=-241.8 kJ•mol-1 | |
| B. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
| A. | 标准状况下,22.4L由O2、和NO2组成的混合气体含有的原子数为2NA | |
| B. | 1mol羟基与1mol氢氧根离子含有的电子数均为9NA | |
| C. | 0.1molFe2+与足量H2O2溶液反应,转移的电子数为0.1NA | |
| D. | 1L1 mol•L-1NaF溶液中含有F-的数目为NA |