题目内容
3. 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,完成下列问题:
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,完成下列问题:①电子通过外电路从a极流向b极(填a或b).
②b极上的电极反应式为:O2+4e-+4H+=2H2O.
③每转移0.1mol电子,消耗H2的体积为1.12L(标准状况下).
分析 该电池呈酸性,通入燃料氢气的电极为负极,电极反应式为H2-2e-═2H+,通入氧气的一极为电池的正极,发生还原反应,反应为O2+4e-+4H+=2H2O,电子从负极沿导线流向正极,放电时,电解质中阳离子向正极移动,结合电极方程式计算.
解答 解:①燃料电池中,通入燃料氢气的电极是负极,则a是负极,通入氧化剂的电极b是正极,电子从负极a沿导线流向正极b,
故答案为:a;b;
②通入氧气的一极为电池的正极,发生还原反应,则b是正极,电极反应式为O2+4e-+4H+=2H2O,
故答案为:O2+4e-+4H+=2H2O;
③通入燃料氢气的电极为负极,电极反应式为H2-2e-═2H+,每转移0.1mol电子,消耗H2的物质的量为0.05mol,其体积在标准状况下为1.12L;
故答案为:1.12.
点评 本题考查化学电源新型电池,燃料电池中通入燃料的电极都是负极、通入氧化剂的电极都是正极,会结合电解质溶液酸碱性书写电极反应式,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
14.H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等.

(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2的电子式为 .
.
(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为O2+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2O2
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是H2O2使病毒蛋白质发生变性,失去活性.
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
填写表中缺少的内容:Ⅱ12%;Ⅲ1.0;Ⅳ催化剂对反应速率的影响.
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的正极(选填:“正”或“负”);纳米棒向右(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142kJ•mol-1、497.3kJ•mol-1.则反应2H2O2(l)═2H2O(l)+O2(g)△H=-213.3kJ•mol-1.

(1)实验室可用Na2O2与H2SO4反应制取少量的H2O2,Na2O2的电子式为
 .
.(2)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如1图所示.该方法制取H2O2
的总化学反应方程式为O2+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2O2
(3)医疗上可用质量分数为3%过氧化氢溶液对伤口进行消毒,其消毒原理是H2O2使病毒蛋白质发生变性,失去活性.
(4)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如表所示:
| 试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
| 质量 分数 | 体积/mL | |||||
| Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
| Ⅱ | 温度对反应速率的影响 | 5.0 | 60℃ | 0 | 0 | |
| Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | 0 | |
| Ⅳ | 4.0% | 5.0 | 常温 | 0 | 1.0 | |
(5)由铂(Pt)和金(Au)组成的纳米棒放入H2O2溶液中(如下图),纳米棒将发生定向移动.
则:Au一侧为电池的正极(选填:“正”或“负”);纳米棒向右(选填:“左”或“右”)移动.
(6)断裂1mol过氧化氢中的O-O键和氧气中的O=O键所需的能量依次分别为142kJ•mol-1、497.3kJ•mol-1.则反应2H2O2(l)═2H2O(l)+O2(g)△H=-213.3kJ•mol-1.
11.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 25℃时,15g乙烷气体中含3.5NA个共价键 | |
| B. | 标准状况下,22.4L苯在Fe 催化条件下可与NA个Br2发生取代反应 | |
| C. | 18g2H2O中含有电子数为10NA | |
| D. | 1molN2和3molH2发生反应N2(g)+3H2(g)?2NH3(g),共有6NA个电子转移 |
8.下列说法正确的是( )
①用浓氨水清洗做过银镜反应的试管;
②用酒精清洗做过碘升华的烧杯;
③氢氟酸保存在玻璃瓶中,烧碱溶液存放在带有玻璃塞的试剂瓶中;
④液溴直接存放在棕色滴瓶中,浓硝酸保存在带橡胶塞的无色玻璃瓶中;
⑤少量金属钠保存在煤油中,少量白磷保存在水中.
①用浓氨水清洗做过银镜反应的试管;
②用酒精清洗做过碘升华的烧杯;
③氢氟酸保存在玻璃瓶中,烧碱溶液存放在带有玻璃塞的试剂瓶中;
④液溴直接存放在棕色滴瓶中,浓硝酸保存在带橡胶塞的无色玻璃瓶中;
⑤少量金属钠保存在煤油中,少量白磷保存在水中.
| A. | ②⑤ | B. | ①②③④ | C. | ①②③⑤ | D. | 全都正确 |
12.已知2SO2(g)+O2?2SO3(g)(正反应放热).若在500℃和催化剂的作用下,该反应在容积固定的密闭容器中进行,下列有关说法正确的是( )
| A. | 若降低温度,可以加快反应速率 | |
| B. | 在上述条件下,SO2能完全转化为SO3 | |
| C. | 反应达平衡时,SO2和SO3的浓度一定相等 | |
| D. | 反应达平衡时,正反应速率和逆反应速率一定相等 |
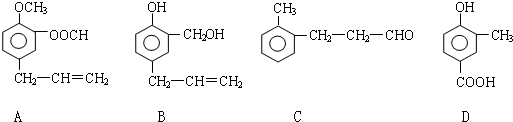
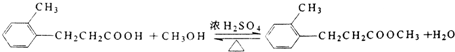 .
.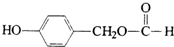 ;H:
;H: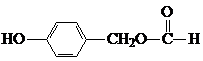 .
.