题目内容
一定温度下在一密闭容器中反应:2NO(g)+O2(g)?2NO2(g)△H<0 达平衡,当改变下列外界条件时,平衡将向哪个方向移动(填正反应方向、逆反应方向、不移动):
①升高温度 ;②降低压强 ;③再通入一定量O2 ,重新达平衡后,NO的转化率 (填升高、降低、不变),O2转化率 (填升高、降低、不变);④恒容下通入惰性气体 ;⑤加入催化剂 .
①升高温度
考点:化学平衡的影响因素
专题:化学平衡专题
分析:该反应是正反应气体体积减小的放热反应,影响平衡移动的因素有温度、浓度和压强,依据勒夏特列原理分析即可.
解答:
解:该反应是正反应气体体积减小的放热反应,
①升温平衡向吸热的逆向移动,故答案为:逆反应方向;
②减压平衡向气体体积增大的逆反应方向移动,故答案为:逆反应方向;
③增大氧气浓度,平衡正向移动,NO的转化率增大,氧气转化率减小,故答案为:正反应方向;增大;减小;
④恒容通入惰性气体,反应物和生成物气体浓度不变,平衡不移动,故答案为:不移动;
⑤催化剂不影响平衡移动,故答案为:不移动.
①升温平衡向吸热的逆向移动,故答案为:逆反应方向;
②减压平衡向气体体积增大的逆反应方向移动,故答案为:逆反应方向;
③增大氧气浓度,平衡正向移动,NO的转化率增大,氧气转化率减小,故答案为:正反应方向;增大;减小;
④恒容通入惰性气体,反应物和生成物气体浓度不变,平衡不移动,故答案为:不移动;
⑤催化剂不影响平衡移动,故答案为:不移动.
点评:本题考查了外界条件对化学平衡移动的影响,注意利用勒夏特列原理分析,题目难度不大.

练习册系列答案
相关题目
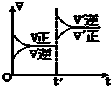 对达到平衡状态的可逆反应:X+Y?W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是( )
对达到平衡状态的可逆反应:X+Y?W+Z,在t℃时增大压强,则正逆反应速率变化如图所示(V代表速率,t代表时间)下列有关X、Y、Z、W的状态叙述正确的是( )| A、X、Y、W为气体,Z不是气体 |
| B、X、Y为气体,W、Z中有一种是气体 |
| C、W、Z为气体,X、Y中有一种是气体 |
| D、W、Z中有一种为气体,X、Y都不是气体 |
在500℃和催化剂存在的条件下,在固定容积的容器中发生如下反应2SO2(g)+O2(g)
2SO3(g)(正反应放热).下列有关说法正确的是( )
| 催化剂 |
| 500℃ |
| A、若降低温度,可以加快反应速率 |
| B、在上述条件下,SO2能完全转化为SO3 |
| C、使用催化剂是为了加快反应速率 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
S-诱抗素的分子结构如图所示,下列关于该物质的说法正确的是( )


| A、其分子式为C15H22O4 |
| B、1 mol该物质与足量NaOH溶液反应,最多消耗2 mol NaOH |
| C、一定条件下,l mol该有机物最多可与4 mol氢气发生加成反应 |
| D、既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
常温下,下列溶液中能大量共存的离子是( )
A、在
| ||
| B、由水电离出的c(H+)和c(OH-)浓度的乘积为10-22的溶液H+、K+、ClO-、SO42- | ||
| C、在pH=7的溶液中,Fe3+、K+、Cl-、SO32- | ||
| D、甲基橙显红色的溶液中,Na+、K+、Cl-、S2O32- |
2.4gCu投入适量的浓硝酸充分反应后,铜粉完全溶解,收集到1.2L标准状态下的气体,如将此气体通过足量水,最后收集到标准状况下气体的体积为( )
| A、560mL |
| B、448mL |
| C、600mL |
| D、400mL |