题目内容
16.常温下,下列各组离子在指定条件下能大量共存的是( )| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 无色透明的酸性溶液中:Al3+、NH4+、Cl?、HCO3? | |
| C. | pH=1的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3 COO-、SO42-、Na+、NH4+ |
分析 A.碳酸氢根离子水解,溶液呈弱碱性;
B.铝离子与碳酸氢根离子发生双水解反应,碳酸氢根离子与酸性溶液中的氢离子反应;
C.pH=1的溶液中存在大量氢离子,次氯酸根离子与氢离子反应,次氯酸根离子能够氧化亚铁离子;
D.由水电离的c(OH-)=10-14mol•L-1的溶液中存在大量氢离子或氢氧根离子,醋酸根离子与氢离子反应,铵根离子与氢氧根离子反应.
解答 解:A.HCO3-在溶液中发生水解,溶液呈弱碱性,四种离子之间不发生反应,能够大量共存,故A正确;
B.酸性溶液中存在大量氢离子,HCO3?与氢离子反应,Al3+、HCO3?之间发生双水解反应,在溶液中一定不能大量共存,故B错误;
C.pH=1的溶液中存在大量氢离子,ClO-、Fe2+之间发生氧化还原反应,ClO-与氢离子反应,在溶液中一定不能大量共存,故C错误;
D.由水电离的c(OH-)=10-14mol•L-1的溶液中存在大量氢离子或氢氧根离子,CH3COO-、与氢离子反应,NH4+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 L的H2O中含有的分子数为NA | |
| B. | 7.8g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 46克 Na与足量氧气反应转移的电子数为2NA | |
| D. | 1 L 1mol•L-1 Na2CO3溶液中含有的钠离子数为NA |
4.下列实验能达到预期实验目的是( )
| 实验 | 实验目的 |
| A.测定等物质的量浓度的 CH3COONa和Na2S溶液pH | 比较 CH3COOH和H2S的酸性强弱 |
B.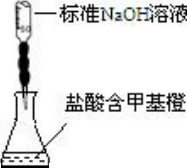 | 测定盐酸的浓度 |
C.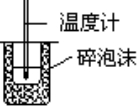 | 测定中和热 |
| D.先用酚酞,后用甲基橙作指示剂,用标准盐酸滴定0.1 mol/L的Na2CO3溶液 | 证明 CO32-水解分两步 |
| A. | A | B. | B | C. | C | D. | D |
11.已知:4NH3+5O2=4NO+6H2O,若反应速率分别用ν(NH3)、ν(O2)、ν(NO)、ν(H2O)表示,则正确的关系是( )
| A. | 5ν(NH3)=4ν(O2) | B. | 5ν(O2)=6ν(H2O) | C. | 2ν(NH3)=3ν(H2O) | D. | 5ν(O2)=4ν(NO) |
8.常温下,能在铁制容器中贮存的物质是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 硫酸铜溶液 | D. | 氯化铁溶液 |
5.相同物质的量的下列各烃,完全燃烧消耗氧气最多的是( )
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C2H6 |
11.下列关于油脂叙述不正确的是( )
| A. | 从溴水中提取溴可用植物油作萃取剂 | |
| B. | 用热碱去油效果好 | |
| C. | 硬水使肥皂去污能力减弱是因为发生了沉淀反应 | |
| D. | 用热的纯碱可区别植物油和矿物油 |



 .
. .
. .
. .
.