题目内容
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.(1)将钠、钾、镁、铝各1![]() 分别投入足量的0.1
分别投入足量的0.1![]() 的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
的盐酸中,试预测实验结果:______与盐酸反应最剧烈,______与盐酸反应最慢。
(2)将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计______(填“合理”或“不合理”),理由是________________________。
。此设计______(填“合理”或“不合理”),理由是________________________。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
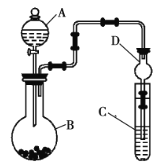
(3)仪器![]() 的名称为____________,干燥管
的名称为____________,干燥管![]() 的作用是__________________。
的作用是__________________。
(4)实验室中现有药品:![]() 溶液、
溶液、![]() 浓盐酸、
浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置![]() 、
、![]() 、
、![]() 中所装药品分别为____________、____________、____________,装置
中所装药品分别为____________、____________、____________,装置![]() 中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______________________________________。
(5)若要证明非金属性:![]() ,则
,则![]() 中加__________,
中加__________,![]() 中加
中加![]() ,
,![]() 中加__________,观察到
中加__________,观察到![]() 中的现象为______________________________。
中的现象为______________________________。
【答案】钾 铝 不合理 ![]() 为活泼非金属元素,不表现金属性 分液漏斗 防止倒吸 浓盐酸
为活泼非金属元素,不表现金属性 分液漏斗 防止倒吸 浓盐酸 ![]()
![]() 溶液
溶液  稀硫酸
稀硫酸 ![]() 溶液(合理即可) 有白色沉淀产生
溶液(合理即可) 有白色沉淀产生
【解析】
(1)元素的金属性越强,其单质与酸反应越剧烈;
(2)元素的金属性越强,其最高价氧化物的水合物碱性越强;
(3)A为分液漏斗;有缓冲作用的装置能防止倒吸;
(4)元素的非金属性越强,其单质的氧化性越强,要想验证非金属性Cl>S,根据实验药品可以通过单质之间的置换反应来验证;
(5)由B中药品为Na2CO3可知,用最高价氧化物对应水化物的酸性强弱判断对应元素的非金属性强弱,所以A中加入稀硫酸,C中可加入Na2SiO3溶液。
I、(1)同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,同一主族,原子序数越大,金属性越强,其单质与酸或水反应越剧烈,所以金属性K>Na>Mg>Al,则K与盐酸反应最剧烈,最慢的是Al,故答案为:钾;铝;
(2)元素的金属性越强,其最高价氧化物的水合物碱性越强,N元素是非金属元素,不表现金属性,所以不能根据一水合氨和NaOH碱性强弱判断Na的金属性强于N,故答案为:不合理;N为活泼非金属元素,不表现金属性;
Ⅱ、(3)仪器A为分液漏斗,球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中,故答案为:分液漏斗;防止倒吸;
(4)要证明非金属性Cl>S,只要证明其单质的氧化性:Cl2>S即可,A中盛放液体、B中盛放固体、C中盛放液体,氯气用浓盐酸和高锰酸钾制取,所以A中盛放浓盐酸、B中盛放高锰酸钾、C中盛放硫化钠溶液,氯气和硫化钠反应生成S和NaCl;装置C中有淡黄色固体生成,该固体是S,反应方程式为S2-+Cl2=S↓+2Cl-,故答案为:浓盐酸;KMnO4;Na2S溶液; ;
;
(5)由![]() 中药品为
中药品为![]() 可知,用最高价氧化物对应水化物的酸性强弱判断对应元素的非金属性强弱,所以
可知,用最高价氧化物对应水化物的酸性强弱判断对应元素的非金属性强弱,所以![]() 中加入稀硫酸,
中加入稀硫酸,![]() 中可加入
中可加入![]() 溶液;故答案为:稀硫酸;
溶液;故答案为:稀硫酸;![]() 溶液(合理即可);有白色沉淀产生。
溶液(合理即可);有白色沉淀产生。

 发散思维新课堂系列答案
发散思维新课堂系列答案