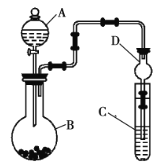
题目内容
【题目】已知铷(![]() )是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
)是37号元素,其相对原子质量是85.5,与钠位于同一主族,回答下列问题:
(1)铷位于第______周期,其原子半径比钠元素的原子半径______(填“大”或“小”)。
(2)铷单质性质活泼,写出在点燃条件下它与氯气反应的化学方程式:________________________;铷单质易与水反应,反应的离子方程式为________________________,实验表明铷与水反应比钠与水反应______(填“剧烈”或“缓慢”);反应过程中铷在水______(填“面”或“底”)与水反应,原因是__________________。
(3)同主族元素的同类化合物的化学性质相似,写出过氧化铷与![]() 反应的化学方程式:________________。
反应的化学方程式:________________。
【答案】5 大 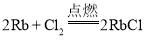
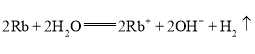 剧烈 底 铷的密度比水的密度大
剧烈 底 铷的密度比水的密度大 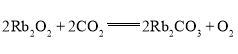
【解析】
铷是37号元素,原子结构中有5个电子层, Rb为碱金属元素,根据Na的性质结合同主族金属元素的性质递变规律来分析。
(1)铷是37号元素,原子结构中有5个电子层,最外层电子数为1,则位于第五周期,原子半径比钠原子大,故答案为:5;大;
(2)铷单质性质与钠的性质相似,但比钠更活泼,与氯气反应生产氯化铷,化学方程式为: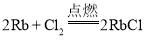 ;与水反应生成氢氧化铷:
;与水反应生成氢氧化铷: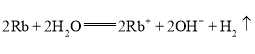 ,比与水反应更剧烈,由于铷的密度比水大,反应时铷沉在水底;故答案为:
,比与水反应更剧烈,由于铷的密度比水大,反应时铷沉在水底;故答案为: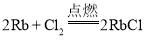 ;
;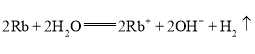 ;剧烈;底;铷的密度比水的密度大;
;剧烈;底;铷的密度比水的密度大;
(3)过氧化钠与二氧化碳反应生成碳酸钠和氧气,同主族元素的同类化合物的化学性质相似,过氧化铷与二氧化碳生成碳酸铷和氧气: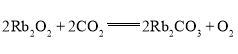 ;故答案为:
;故答案为: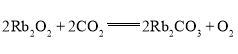 。
。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。