题目内容
20.500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g)?N2O4(g),平衡后,向容器内再充入1molNO2,下列说法正确的( )| A. | 容器内气体颜色先变深后变浅,最后比原来还要浅 | |
| B. | 平衡常数K增大 | |
| C. | 平衡向正反应方向移动 | |
| D. | NO2的转化率变小 |
分析 在恒容密闭容器中可逆反应平衡后,向容器内再充入1molNO2,则物质的量增大,压强增大,平衡正向移动,以此来解答.
解答 解:A.再充入1molNO2,平衡后其浓度大于原来的平衡浓度,则容器内气体颜色先变深后变浅,最后比原来还要深,故A错误;
B.温度不变,则平衡常数不变,故B错误;
C.由上述分析可知,平衡正向移动,故C正确;
D.相当于增大压强,平衡正向移动,转化率增大,故D错误.
故选C.
点评 本题考查化学平衡的影响因素,为高频考点,侧重考查学生的分析能力,明确压强对平衡的影响即可解答,注重基础知识的考查,题目难度不大,A为解答的易错点.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
8.某元素气态氢化物的化学式为H2X,则此元素最高价氧化物对应的水化物的化学式应是( )
| A. | H2XO3 | B. | H2XO4 | C. | H3XO4 | D. | HXO4 |
11.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{放电}^{充电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时K+向正极方向移动 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4H2O | |
| C. | 放电时每转移3 mol电子,正极有2 mol K2 FeO4被还原 | |
| D. | 放电时正极附近溶液的碱性增强 |
8.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| B. | 32 g S8单质(S8分子结构如图)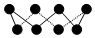 中含有的S-S键个数为8NA 中含有的S-S键个数为8NA | |
| C. | 17g的氢氧根离子中含有的电子数为9NA | |
| D. | 常温下,4.6gNa和足量的O2完全反应失去电子数为0.2NA |
15.下列有机物,按沸点由高到低的顺序排列正确的是( )
①庚烷 ②己烷 ③正戊烷 ④新戊烷 ⑤异丁烷.
①庚烷 ②己烷 ③正戊烷 ④新戊烷 ⑤异丁烷.
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
5.向a mL 18mol•L-1的浓硫酸中加入足量铜片,并加热,被还原的H2SO4的物质的量和起酸性作用的H2SO4的物质的量分别为( )
| A. | 大于9a×10-3mol,小于18a×10-3mol | B. | 都等于9a×10-3mol | ||
| C. | 都等于18a×10-3mol | D. | 都小于9a×10-3mol |
12.根据热化学方程式:S(s)+O2(g)═SO2(g)△H=a kJ•mol-1(a=-297.2),判断下列说法中不正确的是( )
| A. | S(s)在O2(g)中燃烧的反应是放热反应 | |
| B. | S(g)+O2(g)═SO2(g)△H=b kJ•mol-1,则a<b | |
| C. | 1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 | |
| D. | 16 g固体硫在氧气中充分燃烧,可放出148.6 kJ热量 |
9.以下物质的每步转化都可以通过一步反应实现的是( )
| A. | Al→Al2O3→A1(OH)3→NaAlO2 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→Na2SiO3→H2SiO3 | D. | Na→Na2O2→Na2CO3→NaOH |



