题目内容
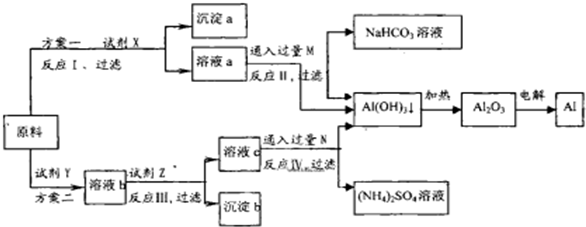
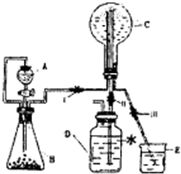
(11分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参加反应)。请回答下列问题:

(1)该实验中炼铁的方法是 填字母)。
A、热分解法 B、热还原法 C、电解法 D、湿法冶金
(2)实验开始后,B中的现象是 。
A中有关反应的化学方程是 。
(3)C处须进行尾气处理,其方法是 。
(4)若样品的质量为3.6g,通入足量的CO充分反应后,B增重2.64g,则样品中铁的质量分数为 (结果保留一位小数)。
【答案】
(1)B(2分)
(2)有白色沉淀生成;Fe2O3+3CO 2Fe+CO2(各2分)
2Fe+CO2(各2分)
(3)点燃(划接储气球)(2分)
(4)62.2%(3分)
【解析】该实验是用热还原法来制取铁:Fe2O3+3CO 2Fe+CO2,产生的CO2可使澄清的石灰水变浑浊,过多的CO为避免污染环境一般用燃烧法除去。
2Fe+CO2,产生的CO2可使澄清的石灰水变浑浊,过多的CO为避免污染环境一般用燃烧法除去。
(4)2Fe~Fe2O3~3CO2
即:2×56g 3×44g
m 2.64g 可求出其中铁元素为2.24g,其含量为2.24/3.6=62.2%

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
(10分)实验室可以用下图装置进行CO还原赤铁矿(主要成分为Fe2O3)并测定其中铁的含量的实验(假设杂质不参与反应)。请回答下列问题:
(1)该实验中炼铁的方法是________(填字母)。
| A.热分解法 | B.热还原法 |
| C.电解法 | D.湿法冶金 |
(3)写出铝和Fe2O3 反应的化学方程式 演示实验引发该反应的方法是
(4)若样品的质量为3.6 g,通入足量的CO充分反应后,B增重2.64 g,则样品中铁的质量分数为_____ _ (结果保留一位小数)。