题目内容
化学反应
2A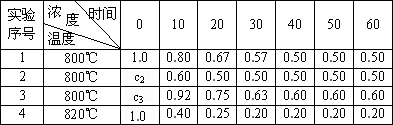
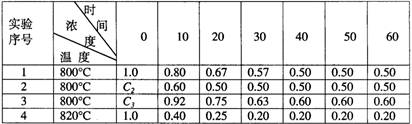
根据上述数据,完成下列填空:
(1)实验1,反应在10 min~20 min内的平均速率为________mol/(L·min).
(2)实验2,A的初始浓度c2为________mol/L,反应经20 min可达到平衡,据此推测实验2中还隐含的条件是________.
(3)设实验1中该反应的反应速率为v1,实验3中该反应的反应速率为v3,则有
v1________v3(填“>”、“=”或“<”),且c3________1.0 mol/L(填“>”、“=”或“<”)
(4)比较实验1和实验4,可推测该反应是________反应(填“吸热”或“放热”),理由是________.
解析:
|
答案: (1)0.013 (2)1.0 起始物中加入了催化剂 (3)< > (4)吸热 升高温度,平衡正向移动讲析:本题以化学平衡为背景,主要考查:①化学反应速率的基本概念及有关计算;②等效平衡;③化学平衡常数的概念及运用;④影响化学平衡的因素. (2)对比实验1与实验2的数据,分析可知,平衡时反应物A的浓度均为0.50 mol/L,两者的化学平衡可视为等效平衡,这样容易得到c2=1.0 mol/L.实验2相比实验1达到平衡的时间较短,反应温度、起始浓度均一样,可知实验2中加入了催化剂. (3)对比实验1与实验3的数据可知,从10 min~20 min,实验1中A的浓度变化值为0.13 mol/L,而实验3中A的浓度变化值为0.17 mol/L,说明v3>v1.对于反应体系,随着反应的进行,浓度减小,反应速率随之减小,可知从0~10 min A的浓度的变化值应大于0.17 mol/L,即c3>(0.92+0.17)mol/L=1.09 mol/L. (4)由实验1和4的数据可知,平衡时:c(A)=0.2 mol/L<0.5 mol/L,故升高温度使化学平衡正向移动,依据勒夏特列原理有:升高温度,化学平衡向着吸热方向移动,所以正反应为吸热反应. 另解 (3)由实验1数据: 温度不变其平衡常数不变,则: K= 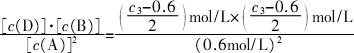 =0.25,解得c3=1.2 mol/L>1.0 mol/L =0.25,解得c3=1.2 mol/L>1.0 mol/L
(4)对比实验1与实验4可知,两个实验的起始浓度相同,反应温度不同,达到平衡时,实验4中A的浓度小,说明了实验4中反应进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应. 点评:本题表格中数据较多,要求同学们对表格中的数据加以对比分析,找出对解题有用的数据.解答信息题,关键要在审清题意的基础上,提炼有效信息,并根据信息的指向解决问题. |

 英才计划期末调研系列答案
英才计划期末调研系列答案某化学反应2A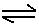 B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行。B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
| 实验序号 | | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,反应在10至20分钟内平均速率为 。
(2)在实验2中,A的初始浓度c2=______ ____,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是______ ____。
(3)设实验3中的反应速率为v3,实验1的反应速率为v1,则v3__________v1(填“>”、“=”或“<”),且c3__________1.0mol·L-1(填“<”、“=”或“>”)。
(4)比较实验4和实验1,可推测该反应是__________反应(填“吸热”或“放热”)。
(8分)(2011·泰州模拟)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
|
实验 序号 |
时间 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800 |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800 |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800 |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820 |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10 min~20 min时间内平均速率为________mol·L-1·min-1。
(2)在实验2中,A的初始浓度c2=________mol·L-1,反应经20 min就达到平衡,可推测实验2中还隐含的条件是________。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3________v1,且c3________1.0 mol/L(填“=”、“>”或“<”)
(4)比较实验4和实验1,可推测该反应是________反应(填“吸热”或“放热”),理由是________________________________________________________________________。

 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: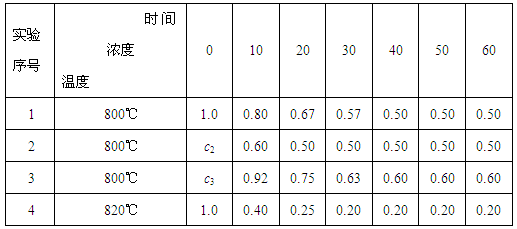
 B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表: