题目内容
某温度时,某反应达到平衡,平衡常数K= .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )A.该反应是焓变为正值,熵变为零
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
 CO2+H2
CO2+H2
【答案】分析:根据平衡常数等于生成物浓度幂之积除以反应物浓度幂之积可知反应的化学方程式为CO2+H2 CO+H2O,恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,结合外界条件对平衡的影响解答该题.
CO+H2O,恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,结合外界条件对平衡的影响解答该题.
解答:解:A.恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,该反应是焓变为正值,由于反应前后气体的体积相等,则熵变为零,故A正确;
B.反应前后气体的体积相等,增大压强平衡不移动,恒温恒容下,增大压强,H2浓度一定增大,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.反应的化学方程式为CO2+H2 CO+H2O,故D错误,
CO+H2O,故D错误,
故选A.
点评:本题考查化学平衡的影响因素,题目难度不大,注意把握题意,掌握化学平衡常数的意义.
 CO+H2O,恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,结合外界条件对平衡的影响解答该题.
CO+H2O,恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,结合外界条件对平衡的影响解答该题.解答:解:A.恒容时,温度升高,H2浓度减小,说明反应向正反应方向移动,则正反应为吸热反应,该反应是焓变为正值,由于反应前后气体的体积相等,则熵变为零,故A正确;
B.反应前后气体的体积相等,增大压强平衡不移动,恒温恒容下,增大压强,H2浓度一定增大,故B错误;
C.升高温度,正逆反应速率都增大,故C错误;
D.反应的化学方程式为CO2+H2
 CO+H2O,故D错误,
CO+H2O,故D错误,故选A.
点评:本题考查化学平衡的影响因素,题目难度不大,注意把握题意,掌握化学平衡常数的意义.

练习册系列答案
相关题目
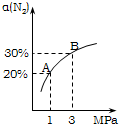 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.N2的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( ) CO2+H2
CO2+H2