��Ŀ����
ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��M��W������X��Z��M��W����Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Ԫ��Yԭ�ӵ�����������������Ӳ�����2����Z��M�������ڣ�M��Wλ��ͬ���塣
��1��Ԫ��W�����ڱ��е�λ���� ��W�������ӽṹʾ��ͼ�� ��
��2��Ԫ��Z�ĵ��ʵĵ���ʽΪ ������£��Թ����ռ���Z���⻯�������ˮ�У����ʲ���ɢ����һ��ʱ����Թ�����Һ�����ʵ���Ũ��Ϊ ��
��3��Ԫ��Y������ͬ���������� �� Y����������еĻ�ѧ������Ϊ ��Y���⻯���к�������ߵ������dz�����ȼ�ϣ�1g��ȼ��ȼ�ղ���CO2(g)��H2O(l)ʱ����55.6kJ����д����ʾ��ȼ��ȼ���ȵ��Ȼ�ѧ��Ӧ����ʽ
��
��4����X��Z��M��W����Ԫ���е�������ɵ�һ��ǿ�ᣬ�����ϡ��Һ����ͭ��Ӧ�����ӷ���ʽΪ ��
��5����X��Z����M��W��Fe����Ԫ����ɵ�Ħ������Ϊ392g/ mol�Ļ�����ף�1 mol���к���6mol�ᾧˮ���Ի������������ʵ�飺
a��ȡ����Һ���������ŨNaOH��Һ�����ȣ�������ɫ��������ɫ�̼�����ζ���塣��һ��ʱ���ɫ������Ϊ����ɫ�����ձ�Ϊ���ɫ��
b����ȡ����Һ���������BaCl2��Һ������ɫ������������������ܽ�
�ټĻ�ѧʽΪ ��
�� ��֪100mL 1 mol/L �ļ���Һ����20mL 1 mol/L������KMnO4��Һǡ�÷�Ӧ��д����Ӧ�����ӷ���ʽ ��
��1�� �������ڵ�VIA����1���� �� S2-����+16 2 8 8 ��1���� ��
��2�� ��N N �� (1��)
�� 0.045mol/L ��1�֣�
��
N �� (1��)
�� 0.045mol/L ��1�֣�
��
��3��ʯī�����ʯ��C60���������������1�֣��� ���Թ��ۼ��ۼ���1�֣���
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ��H=-899.6kJ/mol (2��) ��
��4�� 3Cu+8H++2NO3-=3Cu2++2NO��+4H2O ��2���� ��
��5���� (NH4)2Fe(SO4)2��6H2O��1�֣� ��
�� 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O ��2���� ��
����������

 H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3-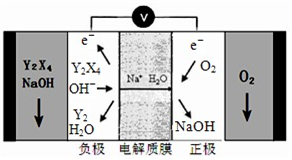
 X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����
X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����