题目内容
向等体积的下列溶液中分别加入0.5mol/L盐酸,则溶液的导电性明显增强的是( )
| A、0.5 mol/L H2SO4 |
| B、0.5 mol/L NaOH |
| C、0.5 mol/L AgNO3 |
| D、0.5 mol/L NH3?H2O |
考点:电解质溶液的导电性
专题:电离平衡与溶液的pH专题
分析:加入0.5mol/L盐酸,溶液导电性明显增强,溶液中离子浓度应增大,结合物质的性质可用排除的方法解答.
解答:
解:A.H2SO4为强电解质,与HCl不反应,加入0.5mol/L盐酸,离子浓度略变小,故A错误;
B.NaOH与HCl发生中和反应,离子的物质的量不变,但体积增大,离子浓度变小,故B错误;
C.AgNO3与HCl反应生成AgCl沉淀,反应后离子的物质的量不变,但溶液体积增大,离子浓度减小,故C错误;
D.NH3?H2O为弱电解质,与HCl反应生成NH4Cl,为强电解质,离子浓度增大,故D正确.
故选D.
B.NaOH与HCl发生中和反应,离子的物质的量不变,但体积增大,离子浓度变小,故B错误;
C.AgNO3与HCl反应生成AgCl沉淀,反应后离子的物质的量不变,但溶液体积增大,离子浓度减小,故C错误;
D.NH3?H2O为弱电解质,与HCl反应生成NH4Cl,为强电解质,离子浓度增大,故D正确.
故选D.
点评:本题考查溶液导电性问题,题目难度不大,注意导电性的强弱取决于溶液离子浓度的大小.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
乙醇分子结构中的各种化学键如图所示,下列关于乙醇在各种反应中断键的说法正确的是( )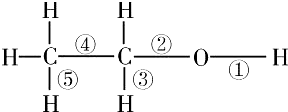

| A、与醋酸、浓硫酸共热时断裂① |
| B、在空气中燃烧时断裂④⑤ |
| C、和金属钠反应时断裂② |
| D、在Cu催化下和O2反应时断裂②③ |
常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法不合理的是( )
| A、反应后HA溶液可能有剩余 |
| B、生成物NaA的水溶液的pH可能小于7 |
| C、HA溶液和NaOH溶液的体积可能不相等 |
| D、HA溶液的c(H+)和NaOH溶液的c(OH-) 可能不相等 |
蓝色的氮化硅硬度大、熔点高、性质稳定,根据性质推测,它不可能的用途是( )
| A、制备光导纤维 |
| B、制汽轮机叶片 |
| C、制永久性模具 |
| D、制造柴油机 |
下列说法正确的是( )
| A、酸式盐的水溶液一定显酸性 |
| B、酸性氧化物一定是非金属氧化物 |
| C、丁达尔效应是溶液和胶体的本质区别 |
| D、HClO是弱酸,但NaClO是强电解质 |
甲醇燃料电池(DMFC)可用于笔记本电脑、汽车等,它一极通入甲醇;电解质是质子交换膜,它能传导氢离子.电池工作时,甲醇被氧化为二氧化碳和水,氧气在电极上的反应是:O2+4H++4e-=2H2O.下列叙述中,不正确的是( )
| A、电池的总反应是:2CH3OH+3O2=2CO2+4H2O |
| B、正极的反应为:O2+4H++4e-=2H2O |
| C、负极的反应为:CH3OH+H2O-6e-=CO2↑+6H+ |
| D、电池工作时,H+由正极移向负极 |
下列条件下,两瓶气体所含原子数一定相等的是( )
| A、同质量、不同密度的N2和C2H4 |
| B、同温度、同体积的H2和N2 |
| C、同体积、同密度的CO和N2 |
| D、同压强、同体积的N2O和CO2 |
