题目内容
几种短周期元素的原子半径及主要化合价如下表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A、X、Y元素的金属性:X比Y强 |
| B、一定条件下,Z单质与W的常见单质直接生成ZW |
| C、Y的最高价氧化物对应的水化物能溶于的Z最高价氧化物对应的水化物的稀溶液中 |
| D、一定条件下,W单质可以和Z氢化物反应直接生成ZW2 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:W化合价为-2价,没有最高正化合价+6价,故W为O元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素.结合元素周期律知识解答该题.
解答:
解:W化合价为-2价,没有最高正化合价+6价,故W为O元素;Z元素化合价为+5、+3、-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素;X化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第ⅢA族元素,二者原子半径相差较小,可知两者位于同一周期相邻主族,由于X、Y的原子半径与W、Z原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,
A.同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,故A正确;
B.在放电条件下氮气与氧气可以化合生成NO,故B正确;
C.Y的最高价氧化物的水化物是氢氧化铝,Z最高价氧化物对应的水化物为硝酸,氢氧化铝与硝酸发生中和反应,故C正确;
D.在催化剂条件下,氨气被氧化生成NO,不能直接生成NO2,故D错误.
故选D.
A.同周期自左而右,金属性减弱,所以X、Y元素的金属性X>Y,故A正确;
B.在放电条件下氮气与氧气可以化合生成NO,故B正确;
C.Y的最高价氧化物的水化物是氢氧化铝,Z最高价氧化物对应的水化物为硝酸,氢氧化铝与硝酸发生中和反应,故C正确;
D.在催化剂条件下,氨气被氧化生成NO,不能直接生成NO2,故D错误.
故选D.
点评:本题考查元素位置结构和性质的关系及应用,为高频考点,侧重于学生的分析能力的考查,题目难度中等,从原子半径的变化和元素的最高正价和最低负价入手寻求突破,正确把握元素化合价、原子半径与元素性质的关系是解答该题的关键,注意把握物质的相关性质.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应不能够发生的是( )
| A、2Fe+3I2=2FeI3 |
| B、3Br2+6FeCl2=2FeBr3+4FeCl3 |
| C、Cl2+2KBr=2KCl+Br2 |
| D、2FeCl3+2KI=2FeCl2+2KCl+I2 |
下列表示物质结构的化学用语或模型正确的是( )
A、苯分子的比例模型: |
B、CO2的电子式: |
C、Cl-离子的结构示意图: |
| D、乙烯的结构式:CH2=CH2 |
用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 ( )(选填编号).
| A、蒸馏 |
| B、用氢氧化钠溶液洗涤 |
| C、用四氯化碳萃取 |
| D、用亚硫酸钠溶液洗涤 |
已知铅蓄电池Pb+PbO2+2H2SO4═2PbSO4+2H2O 在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”.下列说法中正确的是( )
| A、标有“+”的接线柱,充电时作阳极,放电时作负极 |
| B、放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少 |
| C、充电时电路中通过0.1mol电子时,电解质溶液有0.2mol H2SO4产生 |
| D、充电时阳极中PbSO4被还原为PbO2 |
红磷在一定条件下能转变成白磷,同时释放出一定的热能,据此下列结论正确的是( )
| A、红磷和白磷互称同位素 |
| B、相同量的白磷比红磷的总能量低 |
| C、该反应是吸热反应 |
| D、红磷比白磷稳定 |
下列关于电解质叙述正确的是( )
| A、CO2溶于水能部分电离,故CO2属于弱电解质 |
| B、溶于水后能电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水,但硫酸钡属强电解质 |
| D、强电解质溶液的导电性比弱电解质溶液的导电性强 |
豪猪烯(hericenes),形状宛如伏地伸刺的动物,其键线式如图.下列有关豪猪烯的说法正确的是( )
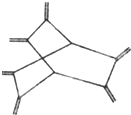

| A、豪猪烯与乙烯互为同系物 |
| B、豪猪烯分子中所有原子在同一平面 |
| C、豪猪烯的分子式为:C14H20 |
| D、豪猪烯能使酸性高锰酸钾溶液褪色 |
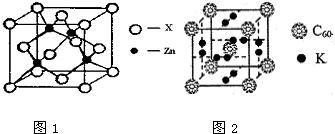 [化学-选修3:物质结构与性质]
[化学-选修3:物质结构与性质]