题目内容
在标准状况下,两种常见气态烃5.6L充分燃烧,生成10.08LCO2(标准状况)和5.4g水,则下列说法正确的是( )
| A、混合烃对氢气的相对密度为24 | B、两者分别是C2H6和C2H4,体积比为1:1 | C、两者分别是CH4和C2H2,体积比为1:4 | D、肯定没有甲烷 |
分析:标况下5.6L混合气体的物质的量为:
=0.25mol,生成的二氧化碳的物质的量为:
=0.45mol,生成水的物质的量为:
=0.3mol,据此可以计算出混合烃的平均分子式,然后质量守恒计算出混合气体的平均相对分子量,根据计算结果对各选项进行判断.
| 5.6L |
| 22.4L/mol |
| 10.08L |
| 22.4L/mol |
| 5.4g |
| 18g/mol |
解答:解:标况下5.6L混合烃的物质的量为0.25mol,生成的二氧化碳和水的物质的量分别为0.45mol、0.3mol,所以混合烃中含有碳原子平均数为:
=1.8,
含有氢原子的平均数为:
=2.4,混合气体的平均分子式为:C1.8H2.4,所以混合气体中一定含有甲烷,由于甲烷中氢原子数为4,则另一种烃中含有的氢原子数目一定小于2.4,则另一种烃只能为乙炔,
根据平均分子式为C1.8H2.4可知,该混合气体的平均分子量为:12×1.8+1×2.4=24,密度与摩尔质量成正比,则该混合烃对氢气的相对密度为:
=12,故A错误;
设甲烷的物质的量为x,乙炔的物质的量为y,根据碳原子守恒,x+2y=1.8(x+y),解得x:y=1:4,所以BD错误,C正确,
故选C.
| 0.45mol |
| 0.25mol |
含有氢原子的平均数为:
| 0.3mol×2 |
| 0.25mol |
根据平均分子式为C1.8H2.4可知,该混合气体的平均分子量为:12×1.8+1×2.4=24,密度与摩尔质量成正比,则该混合烃对氢气的相对密度为:
| 24 |
| 2 |
设甲烷的物质的量为x,乙炔的物质的量为y,根据碳原子守恒,x+2y=1.8(x+y),解得x:y=1:4,所以BD错误,C正确,
故选C.
点评:本题考查了有机物分子式的确定,题目难度中等,注意掌握确定有机物分子式的计算方法,根据质量守恒定律确定碳原子、氢原子的数目是解题关键,明确气体的相对密度的含义及计算方法.

练习册系列答案
相关题目

 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
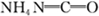
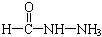

 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是
L。