题目内容
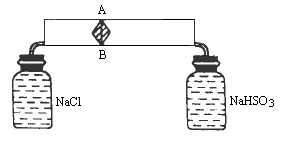
有一干燥的粉末,经初步鉴定,由Na2O2与Na2CO3构成,现对其进行定量分析如图实验.AB为可自由滑动的活塞,与壁间光滑接触且不漏气.左侧瓶中装有NaCl溶液,右边装有浓度较大的NaHSO3.现将粉末搅拌均匀,取等质量两份分别放入两瓶中,立即塞紧瓶塞.当发生的反应结束后发现活塞左右比例为3∶2,假设原活塞内部真空,活塞由两圆锥构成,问混合物的质量百分含量,写出方程式(各种反应).
答案:
解析:
解析:
|
先对活塞受力分析,可知活塞形状在题目中没有影响,进而可知P左=P右,温度相等,由阿伏加德定律可知n左∶n右=V左∶V右.进而可确定Na2O2和Na2CO3的比例. 由题意可知 化学反应:左2Na2O2+2H2O=4NaOH+O2↑ 求得 右:2NaHSO3+Na2CO3=2Na2SO3+H2O+CO2↑ Na2O2+2NaHSO3=Na2SO4+Na2SO3+H2O 求得 所以 故Na2O2质量分数为 Na2CO3的为1-68.8%=31.2% |

练习册系列答案
相关题目