题目内容
某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
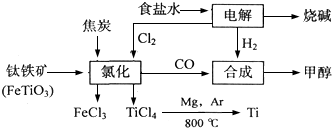
(1)写出电解食盐水反应的离子方程式 .
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: .
(3)已知:
①Mg(s)+Cl2(g)=MgCl2(s);△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=-770kJ?mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H
反应2Mg+TiCl4
2MgCl4+Ti在Ar气氛中进行的理由是 .
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2 t(不考虑生产过程中物质的任何损失).
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是 .

(1)写出电解食盐水反应的离子方程式
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:
(3)已知:
①Mg(s)+Cl2(g)=MgCl2(s);△H=-641kJ?mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=-770kJ?mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H
反应2Mg+TiCl4
| ||
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
考点:副产品的综合利用,用盖斯定律进行有关反应热的计算,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(1)电解食盐水生成NaOH、H2和Cl2,以此书写离子方程式;
(2)钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳;依据原子守恒配平写出;
(3)根据盖斯定律,①×2-②可得;Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化;
4)根据图中流程可知,利用CO和H2,反应生成甲醇,根据所需要的氢气总量减去电解生成总量,计算额外所需氢气的量;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应,负极甲醇消耗氢氧根离子生成碳酸盐.
(2)钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳;依据原子守恒配平写出;
(3)根据盖斯定律,①×2-②可得;Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化;
4)根据图中流程可知,利用CO和H2,反应生成甲醇,根据所需要的氢气总量减去电解生成总量,计算额外所需氢气的量;
(5)碱性甲醇电池中,O2在正极得电子发生还原反应,负极甲醇消耗氢氧根离子生成碳酸盐.
解答:
解:(1)电解食盐水生成NaOH、H2和Cl2,反应的化学方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2
2FeCl3+2TiCl4+6CO;
(3)反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ?mol-1,反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,
故答案为:-512 kJ?mol-1;Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
Cl2~
H2,所以生产1 molCH3OH,理论上还需补充氢气(2-
))mol=
mol,即
gH2,故生产192 t CH3OH还需补充H2的质量10t,故答案为:10;
(5)碱性甲醇电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O.
| ||
| ||
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
| ||
故答案为:2FeTiO3+6C+7Cl2
| ||
(3)反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)可看做反应①×2-②得到,根据盖斯定律得△H-641kJ/mol×2-(-770 kJ/mol)=-512kJ?mol-1,反应2Mg(s)+TiCl4(l)═2MgCl2(s)+Ti(s)在Ar气氛中进行的理由是Mg和Ti都有较强还原性,在高温下都易被空气中的O2氧化,
故答案为:-512 kJ?mol-1;Mg和Ti都有强还原性,在Ar气氛中可以防止被氧化;
(4)根据CO+2H2→CH3OH,CH3OH~CO~
| 7 |
| 6 |
| 7 |
| 6 |
| 7 |
| 6 |
| 5 |
| 6 |
| 5 |
| 3 |
(5)碱性甲醇电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为2CH3OH-12e-+16OH-=2CO32-+12H2O,
故答案为:2CH3OH-12e-+16OH-=2CO32-+12H2O.
点评:本题考查化学方程式的书写及计算、盖斯定律等,题目难度中等,注意根据盖斯定律解题.

练习册系列答案
相关题目
下列物质属于纯净物的是( )
| A、空气 | B、干冰 | C、煤 | D、石油 |
 如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )
如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是( )| A、向NaAlO2溶液中逐渐滴入HCl至过量 |
| B、向澄清石灰水中通入SO2至过量 |
| C、向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量 |
| D、向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量 |
下列鉴别物质的方法能达到目的是( )
| A、用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 |
| B、用焰色反应鉴别NaCl固体和NaOH固体 |
| C、用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| D、用丁达尔效应鉴别NaCl溶液和KCl溶液 |
 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.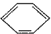 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有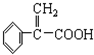 )及高聚物F.
)及高聚物F.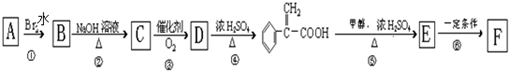
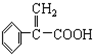 具有相同官能团且属于芳香族化合物的同分异构体有
具有相同官能团且属于芳香族化合物的同分异构体有 的任意一个同分异构体的结构简式
的任意一个同分异构体的结构简式