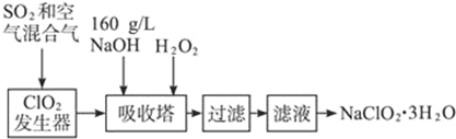
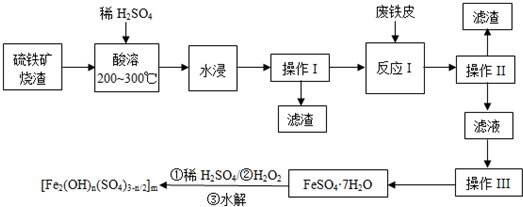
题目内容
5.在一定条件下,气体A可发生反应:2A(g)?B(g)+3C(g),若已知平衡时所得到的混合气体相对于H2的密度为4.25,由此推出A的相对分子质量可能为( )| A. | 8.5 | B. | 17 | C. | 16 | D. | 34 |
分析 令A的物质的量为2mol,由方程式可知,若A完全分解混合气体总物质的量为4mol,根据混合气体相对氢气密度计算混合气体的相对分子质量;若A完全不反应,根据m=nM计算混合气体总质量,由质量守恒定律可知A的质量等于混合气体总质量,再根据M=$\frac{m}{n}$计算A的相对分子质量,则A的相对分子质量介于上述两极值之间.
解答 解:令A的物质的量为2mol,
若A完全反应,由方程式2A=B+3C,可知混合气体总物质的量为1mol+3mol=4mol,混合气体对氢气的相对密度为4.25,则混合气体平均相对分子质量=2×4.25=8.5,
若A完全不反应,混合气体总质量=4mol×8.5g/mol=34g,由质量守恒定律可知A的质量为34g,则A的相对分子质量为$\frac{34}{2}$=17,
故A的相对分子质量介于8.5~17之间,
故选:C.
点评 本题考查混合物计算,注意利用极限法解答,关键是确定极限法的两个端点,为易错题目,学生容易忽略可逆反应而错选B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列有关叙述正确的是( )
| A. | 用浓硝酸可以鉴别毛织物和棉织物 | |
| B. | 葡萄糖和蔗糖不是同分异构体,但是同系物 | |
| C. | 羊毛完全燃烧只生成CO2和H2O | |
| D. | 某学生设计了如图实验方案用以检验淀粉水解的情况: 由以上实验可以得出淀粉已完全水解 |
16.镁条在空气中燃烧后,其生成的产物可能含有的物质是( )
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
13.现有一定质量的Cu和Cu2O组成的混合物溶于足量浓硫酸中,加热使固体完全溶解,共产生11.2LSO2(标准状况),则该混合物的质量可能是( )
| A. | 32g | B. | 50g | C. | 72g | D. | 80g |
10.FeCl2是一种常用的还原剂.有关数据如下:
实验室可以用多种方法来制备无水FeCl2.回答下列问题:
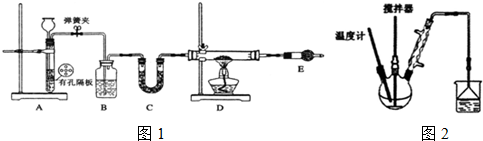
I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
| 相对式量 | 112.5 | 147 | 162.5 | 128 |

I.按如图1装置用H2还原无水FeCl3制取.
(1)用装置A制取H2,其优点是随开随用以及通过开关弹簧夹,可以使反应随时进行或停止;D中反应的化学方程式为H2+2FeCl3$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl2+2HCl.
(2)装置E的作用是吸收氯化氢气体同时防止空气中的水份进入D装置.
Ⅱ.按右图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%.反应如下:2FeCl3+C6H5Cl→FeCl2+C6H4Cl2+HCl
(3)上述反应中,还原剂是C6H5Cl.
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失.原因是实验使用了冷凝回流装置.
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品.
①洗涤所用的试剂可以是苯;
②简述回收滤液中C6H5Cl的方案蒸馏滤液,并收集132℃馏分.
(6)仅通过烧杯中的现象变化就可以监控氯化铁的转化率.若要监控氯化铁转化率达到或超过80%,则烧杯中应加入含溶质为16g且滴有酚酞的NaOH溶液(忽略滞留在装置中的气体).
7.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.2 NA | |
| B. | 标准状况下,5.6L水中含有的分子数为0.25NA | |
| C. | 20g D2O中含有的质子数目为10NA | |
| D. | 标准状况下,22.4 LCO2和O2混合气体中含有的氧原子数为2NA |