题目内容
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大.已知它们的部分化台物的性质如下表所示
回答下列问题
(1)写出X原子的电子排布式 .
(2)A、B、M电负性由大到小的排列顺序为 .
(3)Y的最简单氢化物中,Y原子的杂化形式是 .
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极
性”或“非极性”).
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点.
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 .
| A的最简单氢化物 | B的最简单氢化物 | M的最简单氢化物 | X的氧化物 | Y的最简单氢化物 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 分子呈正四面体构型 | 对应水化物为最强酸 |
(1)写出X原子的电子排布式
(2)A、B、M电负性由大到小的排列顺序为
(3)Y的最简单氢化物中,Y原子的杂化形式是
(4)B的最简单氢化物分子的空间构型是
性”或“非极性”).
(5)比较熔点高低:A最高价氧化物的熔点
(6)判断沸点高低:M氢化物的沸点
考点:原子轨道杂化方式及杂化类型判断,判断简单分子或离子的构型
专题:化学键与晶体结构
分析:A是含氢量最高的有机物,应为CH4;B的最简单氢化物水溶液呈碱性,应为NH3;M的最简氢化物水溶液呈酸性,可能为F、S、Cl等物质的对应的氢化物;X的氧化物为两性氧化物,应为Al,则M为F;Y的最简氢化物分子构型是正四面体,应为Si;Z的最高价氧化物对应的水化物为最强酸,应为Cl元素,结合对应的物质的性质以及题目要求解答该题.
解答:
解:A是含氢量最高的有机物,应为CH4;B的最简单氢化物水溶液呈碱性,应为NH3;M的最简氢化物水溶液呈酸性,可能为F、S、Cl等物质的对应的氢化物;X的氧化物为两性氧化物,应为Al,则M为F;Y的最简氢化物分子构型是正四面体,应为Si;Z的最高价氧化物对应的水化物为最强酸,应为Cl元素.
(1)X为Al,Al原子的电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(2)A、B、M分别为C、N、F元素,同一周期元素从左到右电负性逐渐增大,故电负性大小顺序为M>B>A或F>N>C,故答案为:M>B>A或F>N>C;
(3)Y为Si,其最简单氢化物为SiH4,SiH4中Si原子形成4个δ键,孤电子对数为
=0,则为sp3杂化,故答案为:sp3;
(4)B的最简氢化物为NH3,为三角锥形,正负电荷中心不重合,为极性分子,故答案为:三角锥形;极性;
(5)A、Y分别为C、Si,二者的氧化物分为为二氧化碳、二氧化硅,形成的晶体类型分别为分子晶体、原子晶体,故二氧化碳熔点低于二氧化硅的熔点;
故答案为:低于;
(6)M、Z分别为F、Cl,二者的氢化物分别为HF、HCl,分子间的作用力越大,沸点越高,由于HF分子间能形成氢键,比分子间作用力大,所以HF的沸点高.
故答案为:高于;M的氢化物间存在氢键,比分子间作用力大.
(1)X为Al,Al原子的电子排布式为1s22s22p63s23p1,故答案为:1s22s22p63s23p1;
(2)A、B、M分别为C、N、F元素,同一周期元素从左到右电负性逐渐增大,故电负性大小顺序为M>B>A或F>N>C,故答案为:M>B>A或F>N>C;
(3)Y为Si,其最简单氢化物为SiH4,SiH4中Si原子形成4个δ键,孤电子对数为
| 4-1×4 |
| 2 |
(4)B的最简氢化物为NH3,为三角锥形,正负电荷中心不重合,为极性分子,故答案为:三角锥形;极性;
(5)A、Y分别为C、Si,二者的氧化物分为为二氧化碳、二氧化硅,形成的晶体类型分别为分子晶体、原子晶体,故二氧化碳熔点低于二氧化硅的熔点;
故答案为:低于;
(6)M、Z分别为F、Cl,二者的氢化物分别为HF、HCl,分子间的作用力越大,沸点越高,由于HF分子间能形成氢键,比分子间作用力大,所以HF的沸点高.
故答案为:高于;M的氢化物间存在氢键,比分子间作用力大.
点评:本题考查无机物的推断,侧重于物质的性质、粒子构型以及热化学方程式的书写等问题,综合考查学生的分析能力和基本理论、概念的综合运用,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
汽车尾气的无害化处理已成为当今汽车工业的一项重要课题,其基本原理是实现2NO(g)+2CO(g)?N2(g)+2CO2(g)的反应.关于该反应,下列说法正确的是( )
| A、只要使用合理的催化剂及载体,就可完全清除NO和CO |
| B、该反应达到平衡时v(NO)正=v(CO)逆 |
| C、假设该反应在密闭容器中进行,一段时间后达到平衡时c(NO)=c(CO) |
| D、使用性能好的催化剂可使反应的平衡常数增大 |
铜-锌原电池如图所示,下列叙述正确的是( )
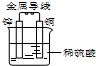

| A、氢离子在负极得电子 |
| B、锌为负极,发生氧化反应 |
| C、铜片上无气泡产生 |
| D、电子从铜片经金属导线流向锌片 |
下表给出几种氯化物的熔点和沸点(*表示在2.5×1.01×105 Pa下测定):
下列有关叙述,不正确的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190* | -68 |
| 沸点(℃) | 1465 | 1418 | 180 | 57 |
| A、AlCl3在加热时升华 |
| B、SiCl4晶体属于分子晶体 |
| C、1500℃时NaCl存在气态分子 |
| D、AlCl3晶体是典型的离子晶体 |
下列各组物质中含有相同分子数的是( )
| A、1g H2和11.2L O2 |
| B、22.4L SO3和64g SO2 |
| C、1mol HCl和22.4L HCl |
| D、28g CO和44g CO2 |
下列关于Na和Na+的叙述中正确的是( )
| A、它们相差一个电子层 |
| B、它们都能与水反应 |
| C、钠原子、钠离子均为同一元素,因此是同种微粒 |
| D、灼烧时,它们的焰色反应都呈紫色 |
日本福岛核事故释放的人工放射性碘
I,半衰期为8.3天,该同位素原子核内的中子数与核外电子数之差是( )
131 53 |
| A、25 | B、78 | C、53 | D、131 |