题目内容
某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
反应方程式:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(1)实验计时方法是从溶液混合开始记时,至 时记时结束
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验I和IV研究 对反应的影响.
| 实验编号 | 0.01mol?L-1 酸性KMnO4溶液 |
0.1mol?L-1 H2C2O4溶液 |
水 | 1mol?L-1 MnSO4溶液 |
反应温度/℃ | 反应时间 |
| I | 2ml | 2ml | 0 | 0 | 20 | 125 |
| II | 1ml | 0 | 20 | 320 | ||
| III | 0 | 50 | 30 | |||
| IV | 2ml | 2ml | 0 | 2滴 | 20 | 10 |
(1)实验计时方法是从溶液混合开始记时,至
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验I和IV研究
考点:探究影响化学反应速率的因素
专题:化学反应速率专题
分析:(1)溶液混合后显示紫红色,当紫红色褪去后计时结束;
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂.
(2)实验I和II研究浓度对反应速率的影响;实验I和III研究温度对反应速率的影响;
(3)MnSO4溶液为催化剂.
解答:
解:(1)实验计时方法是从溶液混合开始记时,到紫红色刚好褪去计时结束,故答案为:紫红色刚好褪去;
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
(3)从实验数据分析,MnSO4溶液在反应中为催化剂,故答案为:催化剂.
(2)根据实验目的,选择合理数据:高锰酸钾作为指示剂,浓度不变,都是2mL;实验I和II研究浓度对反应速率的影响,草酸体积为1mL;实验I和III研究温度对反应速率的影响,浓度全部相同,
故答案为:
| II | 2 | 1 | |
III |
2 | 2 | 0 |
点评:本题考查影响化学反应速率的因素,需要认真分析题中信息,得出合理结论,本题难度中等.

练习册系列答案
相关题目
能用离子方程式H++OH═H2O表示的反应是( )
| A、稀醋酸和稀氨水反应 |
| B、稀硫酸和烧碱溶液反应 |
| C、稀盐酸和氢氧化铜反应 |
| D、稀硫酸和氢氧化钡溶液反应 |
需要加入氧化剂才能发生的变化是( )
| A、HCO3-→CO2 |
| B、Cl-→Cl2 |
| C、MnO4-→Mn2+ |
| D、Fe3+→Fe2+ |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,22.4 L CO2和O2混合气体中含有的氧原子数约为NA |
| B、300 mL 2 mol?L-1蔗糖溶液中所含分子数为0.6 NA |
| C、1 L 1 mol?L-1的K2CO3溶液中离子总数大于3NA |
| D、常温常压下,2.24 L四氯化碳中所含氯原子数约小于0.4 NA |
 用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯 | 芳香烃 | 有机化合物 |
| B | 溶液 | 分散系 | 混合物 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
常温时,下列各组离子在指定溶液中一定能够大量共存的是( )
| A、pH=0的溶液中:Ca2+、Al3+、ClO-、Cl- |
| B、含有大量AlO2-的溶液中:K+、Ca2+、Br-、HCO3- |
| C、加入Mg能放出H2的溶液中:Na+、NH4+、Cl-、SO42- |
| D、酚酞显无色的溶液中:K+、Fe3+、NO3-、SO42- |
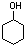 )是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
)是一种有机化工基础原料,工业上的主要合成途径及有关反应如下:
 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.