题目内容
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
(2)实验①和②的目的是
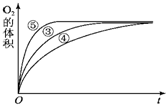
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图.分析如图能够得出的实验结论是
考点:产物的百分含量随浓度、时间的变化曲线
专题:化学平衡专题
分析:(1)pH约为6,则电离生成氢离子,溶液显酸性;
(2)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
(2)实验①和②的浓度不同;为了便于比较,应在相同的条件下利用一个变量来比较;
(3)由图可知,⑤的反应速率最大,④的反应速率最小,以此来解答.
解答:
解:(1)pH约为6,则电离生成氢离子,溶液显酸性,其电离方程式为H2O2?H++HO2-,故答案为:H2O2?H++HO2-;
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(2)实验①和②的浓度不同,则该实验的目的为探究浓度对化学反应速率的影响;为了便于比较,应在相同的条件下利用一个变量来比较,
则向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中),
故答案为:探究浓度对反应速率的影响;向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中);
(3)由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率,
故答案为:碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
点评:本题考查影响化学反应速率的因素,较好的考查学生实验设计、数据处理、图象分析的综合能力,难度中等,注意信息的利用即可解答.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
相同条件下22克下列气体中跟22克二氧化碳的体积相等的是( )
| A、SO2 |
| B、N2 |
| C、N2O |
| D、CO |
下列能达到实验目的是( )
A、 防倒吸 |
B、 排水法收集NO2 |
C、 实验室制氨气 |
D、 除去杂质气体HCl |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: (1)现有以下物质:
(1)现有以下物质: