题目内容
下列事实不能用电化学原理解释的是( )
| A、实验室制氢气时用粗锌比用纯锌放出氢气快 |
| B、镀锌铁(在铁上镀一层锌)比镀锡铁耐腐蚀 |
| C、铝制门窗不用涂刷油漆 |
| D、轮船水线以下的船壳上装一定数量的锌块 |
考点:原电池和电解池的工作原理
专题:
分析:A.原电池能加快化学反应速率;
B.原电池中活泼金属做负极,原电池能加快化学反应速率;
C.铝表面的氧化膜是致密的;
D.原电池中活泼金属做负极.
B.原电池中活泼金属做负极,原电池能加快化学反应速率;
C.铝表面的氧化膜是致密的;
D.原电池中活泼金属做负极.
解答:
解:A.锌与硫酸铜反应生成铜单质,锌与铜和硫酸形成原电池,原电池能加快化学反应速率,故A正确;
B.镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用,故B正确;
C.铝其实常温下很容易被空气中的氧气氧化,但产物会覆盖在铝表面,形成一层致密的保护膜,阻碍铝进一步被氧气氧化,与原电池无关,故C错误;
D.原电池中活泼金属做负极,腐蚀锌,保护了铁,故D正确;
故选C.
B.镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀.所以,镀锌铁比镀锡铁耐用,故B正确;
C.铝其实常温下很容易被空气中的氧气氧化,但产物会覆盖在铝表面,形成一层致密的保护膜,阻碍铝进一步被氧气氧化,与原电池无关,故C错误;
D.原电池中活泼金属做负极,腐蚀锌,保护了铁,故D正确;
故选C.
点评:本题考查原电池,明确原电池的应用是解题的关键,题目难度不大.

练习册系列答案
相关题目
相同质量的钠在下列情况下产生氢气最多的是( )
| A、投入到足量水中 |
| B、投入到足量盐酸中 |
| C、投入到足量CuSO4溶液中 |
| D、用刺有小孔的铝箔包好放入足量水中 |
钢铁在潮湿的空气中会被腐蚀,会发生的原电池反应.以下说法正确的是( )
| A、负极发生的反应为:Fe-3e-=Fe3+ |
| B、正极发生的反应为:2H2O+O2+4e-=4OH? |
| C、原电池是将电能转变为化学能的装置 |
| D、钢铁在水下部分比在空气与水交界处更容易腐蚀 |
下列关于电解质的说法正确的是( )
| A、不是电解质的物质就是非电解质 |
| B、将纯水加热至较高温度,Kw变大 |
| C、BaSO4不溶于水,其水溶液的导电能力很弱,所以为弱电解质 |
| D、电解质在任何状态下都能导电 |
下列说法正确的是( )
| A、垃圾处理常用的方法是卫生填埋、堆肥和焚烧 |
| B、将垃圾分类并回收是处理的发展方向 |
| C、填埋垃圾不需要治理,只需深埋即可 |
| D、垃圾是污染物,不会产生二次污染 |
照反应Br+H2?HBr+H的能量变化示意图,下列叙述正确的是( )
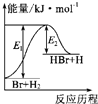

| A、该反应的△H=+(E1-E2)kJ?mol-1 |
| B、加入催化剂,该化学反应的反应热变大 |
| C、反应物的总能量高于生成物的总能量 |
| D、该反应为放热反应 |
