题目内容
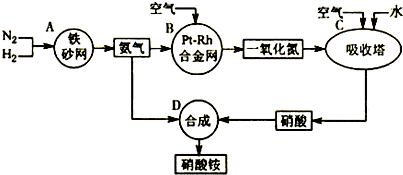
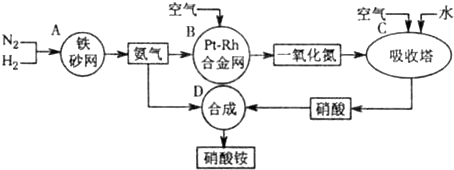
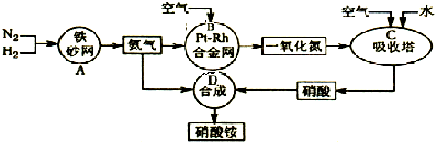
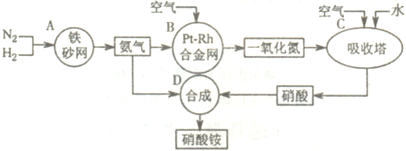
如图是工业生产硝酸铵的流程.

(1)吸收塔C中通入空气的目的是______.A、B、C、D四个容器中的反应,属于氧化还原反应的是______(填字母).
(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:______.
(3)已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有______(填字母).
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,求此时H2的转化率?(要有完整的计算过程,结果保留三位有效数字)
解:(1)吸收塔中涉及的反应有:2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3;为使NO充分氧化而生成硝酸,应通入过量空气;题中涉及的化学反应有:①N2+3H2?2NH3②4NH3+5O2  4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,
4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,
其中①②③④⑤属于氧化还原反应,
故答案为:使NO充分氧化(或者“提高NO的转化率”); ABC;
(2)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=-905.8KJ/mol;
4NO(g)+6H2O(g);△H=-905.8KJ/mol;
故答案为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=-905.8KJ/mol;
4NO(g)+6H2O(g);△H=-905.8KJ/mol;
(3)为提高氢气的转化率,应是反应向正反应方向移动,则可采取的措施有:增大压强、循环利用和不断补充氮气、及时分离出氨气,
故答案为:CD;
(4)设开始时H2的物质的量为3 mol,平衡时变化量为xmol
3H2 (g)+N2 (g)?2NH3(g)
起始量(mol) 3 1 0
变化量(mol) x
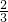 x
x
平衡量(mol) 3-x

则平衡时NH3的体积分数为:
解得x=0.9
∴H2转化率为: ,答:氢气的转化率是30.0%.
,答:氢气的转化率是30.0%.
分析:本题中涉及的化学反应有:N2+3H2?2NH3 、4NH3+5O2 4NO+6H2O、2NO+O2═2NO2 、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3 、NH3+HNO3═NH4NO3
4NO+6H2O、2NO+O2═2NO2 、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3 、NH3+HNO3═NH4NO3
(1)吸收塔中涉及的反应有:2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3;为使NO充分氧化而生成硝酸,应通入过量空气;根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应;
(2)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol;
②N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
(3)为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
(4)根据阿伏加德罗定律结合化学方程式,用三段式计算法计算.
点评:本题以工业合成硝酸铵为载体,考查化学反应与能量、化学平衡等问题,注意外界条件对化学平衡的影响,注意有关化学平衡的计算方法,题目难度中等.
 4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,
4NO+6H2O③2NO+O2═2NO2④3NO2+H2O═2HNO3+NO⑤4NO2+O2+H2O═4HNO3⑥NH3+HNO3═NH4NO3,其中①②③④⑤属于氧化还原反应,
故答案为:使NO充分氧化(或者“提高NO的转化率”); ABC;
(2)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=-1266.8kJ/mol,
②N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol,
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g);△H=-905.8KJ/mol;
4NO(g)+6H2O(g);△H=-905.8KJ/mol;故答案为:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g);△H=-905.8KJ/mol;
4NO(g)+6H2O(g);△H=-905.8KJ/mol; (3)为提高氢气的转化率,应是反应向正反应方向移动,则可采取的措施有:增大压强、循环利用和不断补充氮气、及时分离出氨气,
故答案为:CD;
(4)设开始时H2的物质的量为3 mol,平衡时变化量为xmol
3H2 (g)+N2 (g)?2NH3(g)
起始量(mol) 3 1 0
变化量(mol) x

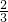 x
x平衡量(mol) 3-x


则平衡时NH3的体积分数为:

解得x=0.9
∴H2转化率为:
 ,答:氢气的转化率是30.0%.
,答:氢气的转化率是30.0%.分析:本题中涉及的化学反应有:N2+3H2?2NH3 、4NH3+5O2
 4NO+6H2O、2NO+O2═2NO2 、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3 、NH3+HNO3═NH4NO3
4NO+6H2O、2NO+O2═2NO2 、3NO2+H2O═2HNO3+NO、4NO2+O2+H2O═4HNO3 、NH3+HNO3═NH4NO3(1)吸收塔中涉及的反应有:2NO+O2═2NO2;3NO2+H2O═2HNO3+NO;4NO2+O2+H2O═4HNO3;为使NO充分氧化而生成硝酸,应通入过量空气;根据反应中各物质的组成元素的化合价是否发生变化来判断是否发生氧化还原反应;
(2)已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol;
②N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol,利用盖斯定律可求知反应热;
(3)为提高某一反应物的转化率,应使平衡向正反应反应方向移动;
(4)根据阿伏加德罗定律结合化学方程式,用三段式计算法计算.
点评:本题以工业合成硝酸铵为载体,考查化学反应与能量、化学平衡等问题,注意外界条件对化学平衡的影响,注意有关化学平衡的计算方法,题目难度中等.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目