题目内容
3.如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法正确的是( )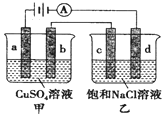
| A. | 向甲中加入适量Cu(OH)2,溶液组成可以恢复 | |
| B. | 电解一段时间,乙溶液中会产生白色沉淀 | |
| C. | 当b极增重3.2g时,d极产生的气体体积为1.12L | |
| D. | 甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O |
分析 由图可知,甲中a与电源正极相连,则a为阳极,b为阴极;乙中c为阳极,d为阴极;a、b、d均为石墨电极,c为Mg电极,则甲池中阳极a电极反应:4OH--4e_=2H2O+O2↑;阴极b电极反应为:2Cu2++4e-=2Cu;乙池中的阳极c电极反应为:2Mg-4e-=2Mg2+;阴极d电极反应为:4H++4e-=2H2↑;甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,乙中发生Mg+2H2O$\frac{\underline{\;通电\;}}{\;}$Mg(OH)2↓+H2↑,以此来解答.
解答 解:A.甲中发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,加入适量CuO,溶液组成可以恢复,而不是Cu(OH)2,故A错误;
B.电解一段时间,阳极Mg溶解得Mg2+,阴极H+放电后促进水电离生成OH-,溶液里产生Mg(OH)2白色沉淀,故B正确;
C.当b极增重3.2g时,根据Cu2++2e-=Cu可知转移0.1mol电子,d极发生4H++4e-=2H2↑,则生成氢气体积在标准状况下为1.12L,未指明标况,无法计算体积,故C错误;
D.甲中b极为阴极,发生的是还原反应,电极反应式为:Cu2++2e-=Cu,故D错误.
故选B.
点评 本题考查了原电池和电解池的工作原理应用,电极判断,电极反应书写,电子转移的计算应用,明确两个烧杯中的电极反应是解答本题的关键,并注意装置特点及电子守恒来解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是( )
| A. | 增加某生成物的质量 | B. | 使用催化剂 | ||
| C. | 升高温度 | D. | 增大反应体系的压强 |
14.下列离子检验的方法正确的是( )
| A. | 某溶液$\stackrel{+AgNO_{3}溶液}{→}$生成白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液$\stackrel{+NaOH溶液}{→}$生成蓝色沉淀,说明原溶液中有Cu2+ | |
| C. | 某溶液$\stackrel{+BaCl_{2}溶液}{→}$生成白色沉淀,说明原溶液中有SO42- | |
| D. | 某溶液$\stackrel{+KOH溶液}{→}$生成红褐色沉淀,说明原溶液中有Mg2+ |
11.某溶液中含有的溶质是FeBr2、FeI2,若向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变成血红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化;
③不能确定通入氯气之后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化.
①原溶液中的Br-一定被氧化
②通入氯气后原溶液中的Fe2+一定被氧化;
③不能确定通入氯气之后的溶液中是否存在Fe2+;
④若取少量所得溶液,再加入CCl4,静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Fe2+、Br-、I-均被完全氧化.
| A. | 只有②③ | B. | 只有②③④ | C. | 只有①④ | D. | ①②③④ |
18.分子式为C4H8O的三元环同分异构体共有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
8.现有组成为CH4O和C3H8O的混合物,在一定条件下脱水,可能得到的有机产物的种类有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
15.下列有关判断正确的是( )
| A. | 0.1mol/LNa2CO3溶液:c(Na+)=2c(H2CO3)+2 c(HCO3-)+c(CO32?) | |
| B. | 能使酚酞溶液呈红色的溶液:Na+、Ba2+、I-、NO3-可以大量共存 | |
| C. | 任何条件下,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 将0.2 mol•L-1的HCN溶液和0.1 mol•L-1的NaOH溶液等体积混合,溶液显碱性,则c(HCN)=c(CN-)=c(Na+) |
16.下列说法中,正确的是(设阿伏加德罗常数的数值为6.02×1023)( )
| A. | MgCl2 的摩尔质量为95 g | |
| B. | 常温常压下,1 mol CO2的质量是44 g | |
| C. | 标准状况下,1 mol H2O所占的体积约为22.4 L | |
| D. | 100 mL 1mol/L的稀硫酸中含有H+ 的数目约为6.02×1022 |
17.用下列试剂和试管中的物质不能完成相应实验目的是( )
| 实验目的 | 试剂 | 试管中的物质 |  | |
| A | 苯环对甲基的影响 | 酸性KMnO4溶液 | ①苯②甲苯 | |
| B | 比较Br-、Fe2+和I-的还原性 | 氯水 | ①FeBr2溶液②FeI2溶液 | |
| C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 | |
| D | 探究接触面积对反应速率的影响 | VmL、cmol/L的盐酸 | ①ag大理石块②ag大理石粉 |
| A. | A | B. | B | C. | C | D. | D |