题目内容
铁和稀硫酸在敞口容器中进行反应:Fe+H2SO4=FeSO4+H2↑,下列叙述不正确的是( )
A、该反应的反应过程与能量关系可以用图表示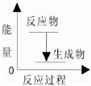 |
| B、若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C、若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D、若将该反应设计成原电池,负极发生的反应是:Fe-2e=Fe2+ |
考点:原电池和电解池的工作原理,反应热和焓变
专题:电化学专题
分析:A、根据放热反应中反应物的总能量大于生成物的总能量;
B、状况不知无法求气体的物质的量,更从求溶解金属的质量;
C、铁是失电子发生氧化反应,作为负极,原电池中阴离子向钡极移动;
D、铁是失电子发生氧化反应,作为负极,负极发生的反应是:Fe-2e=Fe2+.
B、状况不知无法求气体的物质的量,更从求溶解金属的质量;
C、铁是失电子发生氧化反应,作为负极,原电池中阴离子向钡极移动;
D、铁是失电子发生氧化反应,作为负极,负极发生的反应是:Fe-2e=Fe2+.
解答:
解:A、根据放热反应中反应物的总能量大于生成物的总能量,故A正确;
B、状况不知无法求气体的物质的量,更从求溶解金属的质量,故B错误;
C、铁是失电子发生氧化反应,作为负极,原电池中阴离子向钡极移动,故C正确;
D、铁是失电子发生氧化反应,作为负极,负极发生的反应是:Fe-2e=Fe2+,故D正确;
故选B.
B、状况不知无法求气体的物质的量,更从求溶解金属的质量,故B错误;
C、铁是失电子发生氧化反应,作为负极,原电池中阴离子向钡极移动,故C正确;
D、铁是失电子发生氧化反应,作为负极,负极发生的反应是:Fe-2e=Fe2+,故D正确;
故选B.
点评:本题主要考查化学反应中的能量关系,难度不大,根据课本知识即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关乙炔的说法不正确的是( )
| A、燃烧时有浓厚的黑烟 |
| B、实验室制乙炔时可用CuSO4除杂质气体 |
| C、为了减缓电石和水的反应速率,可用饱和食盐水来代替 |
| D、乙炔的收集方法可用排空气法收集 |
在100℃时,NaCl溶液中c(H+)=1×10-6mol?L-1.下列说法中正确的是( )
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显中性 |
| C、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-12 |
大多数有机化合物具有的性质是( )
①容易燃烧 ②受热易分解 ③熔沸点较低 ④副反应较多 ⑤反应较慢 ⑥易溶于极性较小的溶剂.
①容易燃烧 ②受热易分解 ③熔沸点较低 ④副反应较多 ⑤反应较慢 ⑥易溶于极性较小的溶剂.
| A、①②⑥ | B、③④⑤ |
| C、③④⑥ | D、①②③④⑤⑥ |
下列说法中不正确的是( )
| A、蒸馏是分离提纯相互互溶的液态有机物的常用方法 |
| B、石油分馏可获得乙烯、丙烯和丁二烯 |
| C、通过煤的直接或间接液化,可以获得燃料油及多种化工原料 |
| D、重结晶法提纯苯甲酸时,杂质的溶解度很小或很大均易于除去 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、Fe3+、NH4+、NO3-、Cl- |
| B、K+、Na+、SO42-、AlO2- |
| C、Cu2+、Fe2+、OH-、NO3- |
| D、NH4+、K+、HCO3-、Cl- |
某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是( )


| A、4:1 | B、1:1 |
| C、2:1 | D、1:2 |
化学平衡移动的原理在现实生活和生产等社会的许多方面有着广泛的应用.下列应用中涉及的有关原理与化学平衡移动无关的是( )
| A、用酸碱指示剂测定溶液的酸碱性 |
| B、将煤气中毒病人置于高压氧仓中治疗 |
| C、硫酸工业中将硫铁矿粉碎后煅烧 |
| D、交警常用酒精测试仪检查司机是否酒后驾车 |
下列关于元素周期表和元素周期律的说法错误的是( )
| A、F、Cl、Br元素的原子核外电子层数随着核电荷数的增加而增多 |
| B、L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相等 |
| C、因为K比Na容易失去电子,所以K比Na的还原性强 |
| D、周期表中元素最多的族是Ⅷ族,过渡元素全部都为金属元素 |