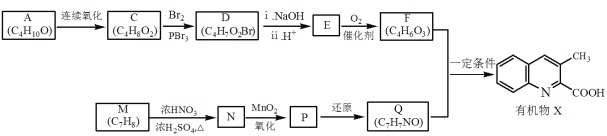
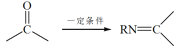
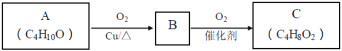
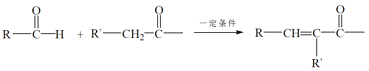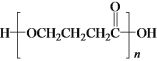题目内容
【题目】(1)配制 500 mL 浓度为 0.2 mol·L-1 稀硫酸,需用量筒量取密度为 1.84 g·cm-3 溶质质量分数为98%的浓 H2SO4 __________mL,然后再与适量水混合稀释,待________ 后,再转移 到____中,定容,摇匀。
(2)在实验(1)中,其他操作均正确,但定容时俯视刻度线,会导致所配制的溶液中溶质的物质的量浓度_________ (填“大于”“小于”或“等于”)0.2 mol·L-1。
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,则所配制的溶液中溶质的物质的量浓度 (填 “大于”“小于”或“等于”)______________0.2 mol·L-1。
【答案】5.4 冷却至室温 500 mL 容量瓶 大于 小于
【解析】
(1)由浓硫酸配制稀硫酸,硫酸溶质的物质的量不变,根据稀释原理,可得,c稀V稀=c浓V浓,c浓硫酸=![]() =
=![]() =18.4mol/L,则V浓=
=18.4mol/L,则V浓=![]() ,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500ml容量瓶中;
,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500ml容量瓶中;
(2) 在实验(1)中,其他操作均正确,但定容时俯视刻度线,容量瓶中溶液的体积偏小,
会导致所配制的溶液中溶质的物质的量浓度偏高;
实验(1)中,转移溶液至容量瓶中时洒落少许,导致溶质的物质的量减少,则所配制的溶液中溶质的物质的量浓度偏小。
(1)由浓硫酸配制稀硫酸,硫酸溶质的物质的量不变,根据稀释原理,可得,c稀V稀=c浓V浓,c浓硫酸=![]() =
=![]() =18.4mol/L,则V浓=
=18.4mol/L,则V浓=![]() ,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500mL容量瓶中,
,浓硫酸稀释过程中会放出大量的热,在转移至容量瓶前需要冷却至室温,再转移至500mL容量瓶中,
故答案为:5.4;冷却至室温;500 mL 容量瓶;
(2) 在实验(1)中,其他操作均正确,但定容时俯视刻度线,容量瓶中溶液的体积偏小,会导致所配制的溶液中溶质的物质的量浓度大于0.2 mol·L-1,
故答案为:大于;
(3)在实验(1)中,转移溶液至容量瓶中时洒落少许,导致溶质的物质的量减少,则所配制的溶液中溶质的物质的量浓度小于0.2 mol·L-1,
故答案为:小于。

【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
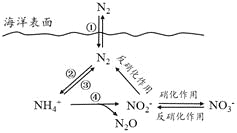
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_______(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
________NH4++ 5O2=2NO2-+ ________H++__________+__________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg | 处理24 h | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是_____________,在最佳反应温度时,48 h内去除氨氮反应的平均速率是____________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。右图是间接氧化工业废水中氨氮(NH4+)的示意图。
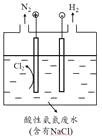
① 结合电极反应式简述间接氧化法去除氨氮的原理:_______________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH将___________(填“增大”、“不变”或“减小”),请简述理由:_______________。