题目内容
A、B、C三种短周期元素,原子序数依次增大,三种元素数依次之和为35,A、C同族,B+离子核外有10个电子,回答下列问题
①A、B、C三种元素分别是____ 、 ____ 、___ __。
②A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为______、__ __、_ __。
③分别写出A、B、C的电子排列式:
A_____;B____;C_____
【答案】
①O、Na、S ②Na2O2、Na2O、Na2S、Na2SO4、Na2SO3、Na2S2O3等
③1s22s22p4; 1s22s22p63s1; 1s22s22p61s23s23p4
【解析】
试题分析:(1)B+离子核外有10个电子,则B是钠元素。由于三种元素数依次之和为35,所以A和C的原子序数之和是24;又因为A、C同主族,所以C的原子序数比A多8个,则A是O,C是S。
(2)A、B、C之间形成多种化合物,其中属于离子化合物的化学式分别为Na2O2、Na2O、Na2S、Na2SO4、Na2SO3、Na2S2O3等。
(3)根据构造原理可知,O、Na、S的核外电子排布式分别是1s22s22p4、1s22s22p63s1、1s22s22p61s23s23p4。
考点:考查元素原子的核外电子排布、离子化合物的判断
点评:本题基础性强,难度不大。主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
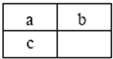 a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )
a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )| A、a与c均存在同素异形体 | B、原子半径由大到小的顺序为:c>a>b | C、b的氢化物的稳定性小于c的氢化物的稳定性 | D、c的单质可用于制造太阳能电池 |
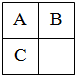 A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A、B与C均不存在同素异形体 | B、X一定是酸性氧化物 | C、B的氢化物比A、C的氢化物稳定 | D、Y与NaOH溶液反应只能生成两种盐 |
 (2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )
(2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )