题目内容
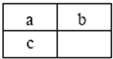 a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )
a、b、c三种短周期元素在元素周期表中的相对位置如图所示,a与b的质子数之和比c的质子数少1,以下说法错误的是( )| A、a与c均存在同素异形体 | B、原子半径由大到小的顺序为:c>a>b | C、b的氢化物的稳定性小于c的氢化物的稳定性 | D、c的单质可用于制造太阳能电池 |
分析:由a、b、c三种短周期元素在元素周期表中的相对位置可知,a、b处于第二周期,c处于第三周期,令a的原子序数为x,则b原子序数为x+1,c原子序数为x+8,a与b的质子数之和比c的质子数少1,则x+x+1+1=x+8,解得x=6,故a为C元素、b为N元素、c为Si元素,据此解答.
解答:解:由a、b、c三种短周期元素在元素周期表中的相对位置可知,a、b处于第二周期,c处于第三周期,令a的原子序数为x,则b原子序数为x+1,c原子序数为x+8,a与b的质子数之和比c的质子数少1,则x+x+1+1=x+8,解得x=6,故a为C元素、b为N元素、c为Si元素,
A.C的单质有金刚石、石墨等同素异形体,Si的单质有晶体硅与无定形硅,都存在同素异形体,故A正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径c>a>b,故B正确;
C.非金属性Si<N,故氢化物稳定性NH3>SiH4,故C错误;
D.晶体硅是良好的半导体材料,可以用于制造太阳能电池,故D正确;
故选C.
A.C的单质有金刚石、石墨等同素异形体,Si的单质有晶体硅与无定形硅,都存在同素异形体,故A正确;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径c>a>b,故B正确;
C.非金属性Si<N,故氢化物稳定性NH3>SiH4,故C错误;
D.晶体硅是良好的半导体材料,可以用于制造太阳能电池,故D正确;
故选C.
点评:本题考查位置结构性质关系,明确短周期及原子序数的关系来推断各元素是解答本题的关键,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
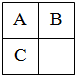 A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )
A、B、C三种短周期元素在周期表中的相对位置如右图所示,已知A、C分别与B形成化合物X和Y,A与B的质子数之和等于C的质子数,则以下说法判断正确的是( )| A、B与C均不存在同素异形体 | B、X一定是酸性氧化物 | C、B的氢化物比A、C的氢化物稳定 | D、Y与NaOH溶液反应只能生成两种盐 |
 (2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )
(2009?三明一模)A、B、C三种短周期元素在周期表中位置如图示,B位于ⅥA族.下列叙述错误的是( )