题目内容
10.已知:在100℃时,水的离子积为1×10-12,此时将pH=12的NaOH溶液V1 L与pH=l的H2SO4溶液V2 L混合,若所得混合溶液的pH=10,则V1:V2为( )| A. | 1:9 | B. | 10:1 | C. | 9:1 | D. | 1:10 |
分析 酸碱溶液混合后溶液呈碱性,则碱过量,根据反应后的pH计算溶液中的c(H+),然后根据水的离子积常数计算c(OH-),利用c(OH-)的计算公式进行计算.
解答 解:在100℃时,水的离子积为1×10-12,此温度下将pH=12的NaOH溶液中c(OH-)=1mol/L,pH=1的H2SO4溶液c(H+)=0.1mol/L,
若所得混合溶液的pH=10,则反应后的溶液的c(OH-)=$\frac{1×1{0}^{-12}}{1{0}^{-10}}$mol/L=0.01mol/L,
则c(OH-)=$\frac{1mol/L×{V}_{1}-0.1mol/L×{V}_{2}}{{V}_{1}+{V}_{2}}$=0.01mol/L,
解得:V1:V2=1:9,
故选A.
点评 本题考查了酸碱溶液混合后溶液pH的计算方法,题目难度中等,注意明确溶液酸碱性与溶液pH的关系,做题时注意把握水的离子积常数随温度的变化而变化.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
1.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| C. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ | |
| D. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- |
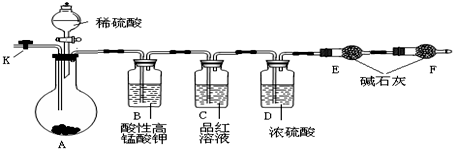
20.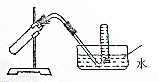 如图装置可用于( )
如图装置可用于( )
 如图装置可用于( )
如图装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和稀HNO3反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用NaCl于浓H2SO4反应制HCl |
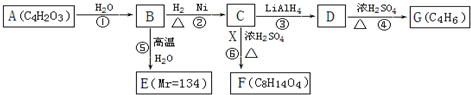
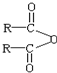 $\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH
$\stackrel{H_{2}O}{→}$2RCOOH,RCOOH$\stackrel{LiAlH_{4}}{→}$RCH2OH ,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.
,1molA和足量的H2反应最多消耗掉H2的物质的量为1mol.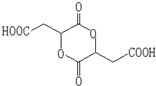 .
.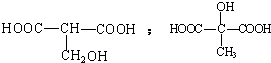 .
.
 .
.