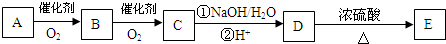题目内容
Ⅰ:(4分)若取4.00mol/L的氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g
Ⅱ:(6分)实验室用4.35gMn02与l00 mL11mol/L的浓盐酸(足量)反应制取氯气。 试计算:
(1)在标准状况下,生成氯气的体积。(不考虑氯气在溶液中的溶解)
(2)将反应后的溶液加水稀释到500mL,向从其中取出的50mL溶液中加入足量AgN03溶液,生成沉淀的物质的量。(要求写出计算过程)
(共10分) Ⅰ:3.12g( 4分)
Ⅱ:(1)MnO2+ 4HCl(浓) ="===" MnCl2+ 2H2O+ Cl2↑
87g 22.4L
4.35g V(Cl2) (1分)
V(Cl2)=1.12L (2分)
(2)n(Cl-)=0.1L×11mol/L-0.1mol=1.0mol
取出50ml后,其中含有n(Cl-)=1.0mol×50ml/500ml=0.1mol (1分)
Cl- + Ag+ = AgCl↓
1mol 1mol
0.1mol n(AgCl) (1分)
n(AgC l) =0.1mol (1分)
【解析】
试题分析:Ⅰ:氨水的物质的量为0.03L×4mol/L=0.12mol,AlCl3的物质的量为0.07L×2mol/L=0.14mol,则
AlCl3+ 3NH3·H2O =Al(OH)3↓+ 3NH4Cl
0.1mol 0.3mol 1mol
0.14mol 0.12mol n
AlCl3过量,按NH3·H2O的量计算,n=0.04mol,即3.12g。
Ⅱ:(1)MnO2+ 4HCl(浓) ="===" MnCl2+ 2H2O+ Cl2↑
87g 22.4L
4.35g V(Cl2) (1分)
V(Cl2)=1.12L (2分)
(2)n(Cl-)=0.1L×11mol/L-0.1mol=1.0mol
取出50ml后,其中含有n(Cl-)=1.0mol×50ml/500ml=0.1mol (1分)
Cl- + Ag+ = AgCl↓
1mol 1mol
0.1mol n(AgCl) (1分)
n(AgC l) =0.1mol (1分)
考点:有关过量问题的计算 氯气的实验室制法 化学方程式的有关计算
点评:本题考查过量问题的计算,题目难度中等,把握物质的反应方程式,根据物质的量,判断过量程度是解答该题的关键。又考查了实验室制取氯气的反应原理和根据化学方程式的计算,以及与制取氯气有关的氧化还原反应知识,较为综合,也较为基础,能很好地考查知识和能力。

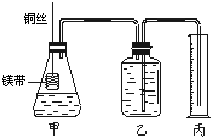 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为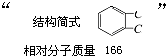 实验室一试剂瓶的标签严重破损,只能隐约看到如图一部分:
实验室一试剂瓶的标签严重破损,只能隐约看到如图一部分: