题目内容
某同学用氯化钠固体配制0.04mol/L的NaCl溶液500mL,设计了如下的操作步骤:A:计算;B:称量;C:洗涤转移;D:定容摇匀;E:溶液转移
回答下列问题
(1)实验中需要称量NaCl固体 g;称量时NaCl固体应该放在托盘天平的 盘.
(2)上述操作步骤的正确顺序是(添字母代号) ;
为保证实验的正常进行,所需仪器除了容量瓶(500mL规格)、托盘天平、量筒外,还要需要的实验仪器有: .
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响是 (选填“偏低”或“偏高”或“无影响”),原因是 .
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响是 (选填“偏低”或“偏高”或“无影响”),原因是 .
回答下列问题
(1)实验中需要称量NaCl固体
(2)上述操作步骤的正确顺序是(添字母代号)
为保证实验的正常进行,所需仪器除了容量瓶(500mL规格)、托盘天平、量筒外,还要需要的实验仪器有:
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因.
①为加速固体溶解,可稍微加热并不断搅拌.在未降至室温时,立即将溶液转移至容量瓶定容.对所配溶液浓度的影响是
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,又滴加蒸馏水至刻度.对所配溶液浓度的影响是
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据0.04mol/L的NaCl溶液500mL中含有的溶质氯化钠的物质的量计算出氯化钠的质量,使用托盘天平时,遵循左物右码原则;
(2)根据配制一定物质的量浓度的溶液步骤进行排序,根据配制方法选择使用的仪器及还缺少的仪器;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据配制一定物质的量浓度的溶液步骤进行排序,根据配制方法选择使用的仪器及还缺少的仪器;
(3)根据c=
| n |
| V |
解答:
解:(1)配制0.04mol/L的NaCl溶液500mL,n(NaCl)=0.04mol/L×0.5L=0.02mol,需要氯化钠的质量为:m(NaCl)=58.5g/mol×0.02mol=1.17g;
根据左物右码原则,称量时NaCl固体应该放在托盘天平的左盘,
故答案为:1.17;左;
(2)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤的正确顺序是:A、B、E、C、D;使用的仪器为:药匙、托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少烧杯、玻璃棒、胶头滴管,
故答案为:A、B、E、C、D;烧杯、玻璃棒、胶头滴管;
(3)①在未降至室温时,立即将溶液转移至容量瓶定容,热的溶液体积偏大,冷却后溶液体积偏小,导致配制的溶液浓度偏高,
故答案为:偏大;溶液未冷却,导致定容时加水不足;
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,属于正常现象,不需要加入蒸馏水,若又滴加蒸馏水至刻度,导致配制的溶液体积偏大,溶液浓度偏小,
故答案为:偏小;倒转摇匀中部分溶液附在容量瓶颈部,故出现溶液液面低于刻度线,若再加水,会使溶液过多.
根据左物右码原则,称量时NaCl固体应该放在托盘天平的左盘,
故答案为:1.17;左;
(2)配制一定物质的量浓度的溶液步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀等,所以操作步骤的正确顺序是:A、B、E、C、D;使用的仪器为:药匙、托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以还缺少烧杯、玻璃棒、胶头滴管,
故答案为:A、B、E、C、D;烧杯、玻璃棒、胶头滴管;
(3)①在未降至室温时,立即将溶液转移至容量瓶定容,热的溶液体积偏大,冷却后溶液体积偏小,导致配制的溶液浓度偏高,
故答案为:偏大;溶液未冷却,导致定容时加水不足;
②定容后,加盖倒转摇匀后,发现溶液面低于刻度线,属于正常现象,不需要加入蒸馏水,若又滴加蒸馏水至刻度,导致配制的溶液体积偏大,溶液浓度偏小,
故答案为:偏小;倒转摇匀中部分溶液附在容量瓶颈部,故出现溶液液面低于刻度线,若再加水,会使溶液过多.
点评:本题考查了配制一定物质的量浓度的溶液方法,题目难度中等,注意掌握配制一定物质的量浓度的溶液的方法,误差分析是本题难点,注意明确误差分析的方法与技巧.

练习册系列答案
相关题目
已知,常温下某浓度NaHSO3稀溶液的pH<7.则该稀溶液中下列粒子关系正确的是( )
| A、c(Na+)>c(HSO3-)>c(H+)>c(OH-) |
| B、c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| C、c(OH-)+c(SO32-)=c(H2SO3)+c(H+) |
| D、c(Na+)+c(H+)=c(HSO3-)+c(OH-) |
下列各组离子中在水溶液中能大量共存的是( )
| A、Fe2+、K+、ClO-、Cl- |
| B、Ag+、Na+、Cl-、NO3- |
| C、NH4+、K+、CO32-、Br- |
| D、H+、Ca2+、CH3COO-、HCO3- |
下列有关实验原理或操作不正确的是( )
A、 如图装置可测定反应速率 |
B、 用如图装置制备Fe(OH)2 |
C、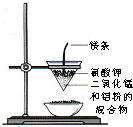 用如图装置制取少量金属锰 |
D、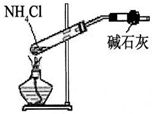 实验室用如图所示装置制取少量氨气 |



