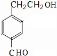
题目内容
(9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 |
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
① CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
② CH3OH(g)+
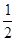 O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2已知H2(g)+
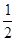 O2(g)===H2O(g) △H =" -241.8" kJ·mol-1
O2(g)===H2O(g) △H =" -241.8" kJ·mol-1则反应②的△H2= kJ·mol-1。
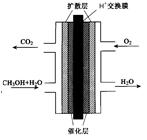
(3)甲醇燃料电池的结构示意图如下。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(1)①CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 ( 2分)
O2(g)===CO2(g)+2H2O(l) ΔH=-726.5 kJ·mol-1 ( 2分)
②-128.1 kJ·mol-1 (2分)
(2)-192.8 (2分)
(3)负(1分) O2 + 4H+ + 4e-="==" 2H2O (2分)
解析

练习册系列答案
相关题目
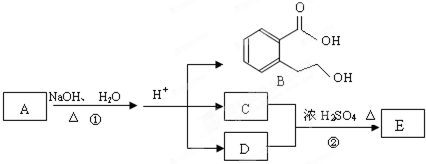

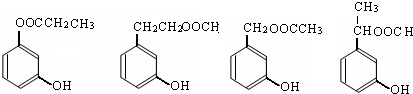 任意1种
任意1种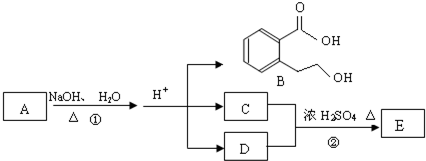

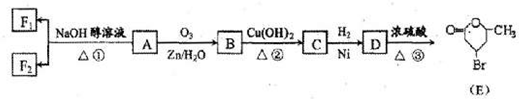
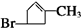


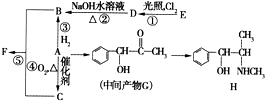 有机物A是重要的化工合成原料,在医药、染料和香料等行业有着广泛的应用.由A制得某药物H的转化关系如图所示(A→G、G→H的反应条件和部分反应物已略去).
有机物A是重要的化工合成原料,在医药、染料和香料等行业有着广泛的应用.由A制得某药物H的转化关系如图所示(A→G、G→H的反应条件和部分反应物已略去).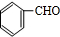
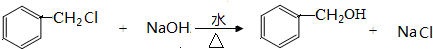
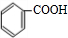 +
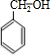
+
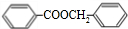 +H2O
+H2O