题目内容
1.下列化学用语中,正确的是( )| A. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 电解饱和食盐水时,阳极的电极反应式为:2Cl-+2e-═Cl2↑ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 氢氧燃料电池(KOH溶液为电解质溶液)的正极反应式:O2+2H2O+4e-═4OH- |
分析 A.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应;
B.电解饱和食盐水时,阴极上氢离子放电;
C.精炼铜时,粗铜作阳极;
D、燃料电池的正极上是氧气得电子的还原反应.
解答 解:A.钢铁发生电化学腐蚀时,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,故A错误;
B.电解饱和食盐水时,阴极上氢离子放电,电极反应式为:2H++2e-═H2↑,阳极的电极反应式为:2Cl--2e-═Cl2↑,故B错误;
C.精炼铜时,粗铜作阳极,与电源正极相连,与电源负极相连的是纯铜,故C错误;
D、燃料电池的正极上是氧气得电子的还原反应,氢氧燃料电池(KOH溶液为电解质溶液)的正极反应式:O2+2H2O+4e-═4OH-,故D正确.
故选D.
点评 本题考查了原电池和电解池原理,明确电极上发生的反应是解本题关键,难点是电极反应式的书写.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
12.美丽的雕花玻璃是用一种物质对玻璃进行刻蚀而制成的,这种物质是( )
| A. | 浓硝酸 | B. | 浓硫酸 | C. | 烧碱 | D. | 氢氟酸 |
9.下列说法不正确的是( )
| A. | 过滤时,玻璃棒与三层滤纸的一边接触,漏斗下端紧贴烧杯内壁 | |
| B. | 分液时,下层液体应从分液漏斗下口放出,上层液体从上口倒出 | |
| C. | 蒸馏时,在蒸馏烧瓶中盛约 $\frac{1}{3}$体积的液体,并放入几粒沸石,将温度计水银球插入液体中,冷水从冷凝管下口进,上口出,收集时,应弃去开始馏出的部分液体 | |
| D. | 加热蒸发氯化钠溶液时,加热到有大量晶体析出时即停止加热,不能加热到全部蒸干 |
16.下列说法正确的是( )
| A. | 过量的100gNa2O2与CO2反应后,固体质量变成了105.6g,此反应转移电子为0.4mol | |
| B. | 在Fe与含nmolHNO3的稀溶液反应中,被还原的HNO3不一定为$\frac{1}{4}$nmol | |
| C. | 在Mg与Al做电极,其它溶液做电解质构成原电池中,Mg一定为负极 | |
| D. | 碱性氧化物一定为金属氧化物,酸性氧化物不一定是非金属氧化物 |
6.对可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 平衡时,v正(O2)=v逆(NO)必成立 | |
| B. | 关系式5v正(O2)=4v正(NO)总成立 | |
| C. | 若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO | |
| D. | 用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最大 |
13.电池对环境的污染目前还没有被人们充分的认识到,下列有关电池污染及回收的有关叙述正确的是( )
| A. | 电池一般比较小,即使埋到土壤中也不会造成太大危害 | |
| B. | 电池回收的主要目的是为了提取里面的银、汞等金属 | |
| C. | 废旧电池可以直接通过燃烧的方式销毁 | |
| D. | 电池不仅污染土壤,也污染地下水 |
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 三种气体密度最小的是X | |
| B. | 分子数目相等的三种气体,质量最大的是Y | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 20℃时,若2molY与1molZ体积相等,则Y、Z气体所承受的压强比为2:1 |
 已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图1所示,试根据上述信息回答下列问题:
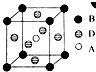 A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.
A、B、C、D、E五种元素是周期表中前四周期的元素.只有A、B、C为金属且同周期,原子序数A<B<C.A、C核外均没有未成对电子;B原子核外有二个未成对电子和三个空轨道.D原子最外层电子数是其周期序数的三倍.E能与D形成化合物ED2,可用于自来水的消毒.