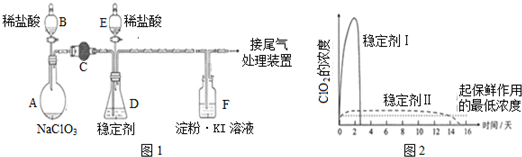
题目内容
19.图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )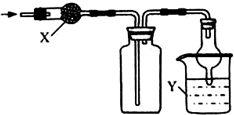
| 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯化氢 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 无水氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 无水氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
分析 由图可知,气体利用固体干燥剂干燥后,利用向上排空气法收集,且气体极易溶于水或气体有毒,最后吸收尾气时防止倒吸,以此来解答.
解答 解:A.HCl不能用碱石灰干燥,故A错误;
B.氨气不能利用向上排空气法收集,故B错误;
C.二氧化硫利用氯化钙干燥后,利用向上排空气法收集,最后利用NaOH溶液吸收尾气,装置合理,故C正确;
D.NO不能利用排空气法收集,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型,涉及气体的收集、尾气处理等,把握实验装置的作用及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列不属于我国“城市空气质量日报”报道内容的是( )
| A. | SO2 | B. | CO2 | C. | PM2.5 | D. | 空气质量等级 |
7.下列说法正确的是( )
| A. | 可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 浓硫酸具有吸水性,可做干燥剂,但不能干燥NH3 | |
| C. | 钠保存在煤油中,若长期放置在空气中,最终变为NaHCO3 | |
| D. | 镁着火后可以用CO2来灭火 |
11.Fe(OH)3胶体和FeCl3溶液共同具备的性质是( )
| A. | 都比较稳定,久置不变浑浊 | B. | 相同的颜色 | ||
| C. | 有丁达尔现象 | D. | 加盐酸先产生沉淀,后沉淀溶解 |
9.亚硫酸钠是食品加工中广泛使用的漂白剂、防腐剂和抗氧化剂,其在食品中的残留量通常以二氧化硫含量计算.
(1)亚硫酸盐具有一定的毒性,长期摄入过量的亚硫酸盐,红细胞和血红蛋白会减少,钙的吸收也会减少,原因是SO32-与Fe2+、Ca2+结合,形成沉淀.
检验某黑木耳中是否含有亚硫酸盐的简单方法是:将黑木耳样品剪成碎末放入烧杯,加入20mL水和10mL盐酸,加热一会儿,滴入试剂A,观察现象既可.
(2)加热的作用是加快亚硫酸钠的溶解,加热时间不能太长的原因是防止亚硫酸受热分解成二氧化硫逸出.
(3)试剂A是品红溶液.
在足量的亚硫酸钠溶液中加入1~2滴液溴,振荡后溶液变为无色.
(4)写出以上反应的离子方程式3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-.
(5)以上反应后的溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等阴离子.设计实验检验SO42-和Br-,写出实验方法.试剂不限.
(1)亚硫酸盐具有一定的毒性,长期摄入过量的亚硫酸盐,红细胞和血红蛋白会减少,钙的吸收也会减少,原因是SO32-与Fe2+、Ca2+结合,形成沉淀.
检验某黑木耳中是否含有亚硫酸盐的简单方法是:将黑木耳样品剪成碎末放入烧杯,加入20mL水和10mL盐酸,加热一会儿,滴入试剂A,观察现象既可.
(2)加热的作用是加快亚硫酸钠的溶解,加热时间不能太长的原因是防止亚硫酸受热分解成二氧化硫逸出.
(3)试剂A是品红溶液.
在足量的亚硫酸钠溶液中加入1~2滴液溴,振荡后溶液变为无色.
(4)写出以上反应的离子方程式3SO32-+Br2+H2O=2HSO3-+SO42-+2Br-.
(5)以上反应后的溶液中含有SO32-、HSO3-、SO42-、Br-、OH-等阴离子.设计实验检验SO42-和Br-,写出实验方法.试剂不限.
| 实验操作 | 预期现象与结论 |
| 步骤1: | 有白色沉淀生成,证明待测液中含SO42- |
| 步骤2: | 溶液呈橙黄色,证明待测液中含Br- |
 有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题:
有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素.X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G的阳离子是胆矾晶体中的中心离子.回答下列问题: .
.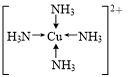 (写在方框内).
(写在方框内).
 硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.
硼及其化合物在工业上有许多用途.工业上以铁硼矿为原料制备硼酸,铁硼矿含有Mg、Fe、Ca、Al、B、O等多种元素,它的主要成分为Mg2B2O5•H2O和Fe3O4.