题目内容
7.在0.2mol•L-1Cu(NO3)2和Fe(NO3)3溶液中,通入一定量H2S气体,下列不可能发生的离子方程式是( )| A. | H2S+2Fe3+→S↓+2Fe2++2H+ | B. | H2S+Fe2+→2H++FeS↓ | ||
| C. | H2S+Cu2+→CuS↓+2H+ | D. | 2H++2NO3-+3H2S→2NO↑+3S↓+4H2O |
分析 当硫化氢足量时可发生反应:H2S+2Fe3+→S↓+2Fe2++2H+、H2S+Cu2+→CuS↓+2H+,当硫化氢少量时发生反应:2H++2NO3-+3H2S→2NO↑+3S↓+4H2O;由于硫化亚铁能够溶于强酸,则亚铁离子不会与硫化氢发生反应生成FeS沉淀,据此进行解答.
解答 解:A.当硫化氢足量时,铁离子能够氧化硫化氢,反应的离子方程式为:H2S+2Fe3+→S↓+2Fe2++2H+,故A错误;
B.由于FeS能够溶于强酸,则不可能发生反应H2S+Fe2+→2H++FeS↓,故B正确;
C.CuS不溶于强酸,则硫化氢可以与铜离子发生反应:H2S+Cu2+→CuS↓+2H+,故C错误;
D.硝酸根离子在酸性条件下具有强氧化性,能够氧化硫化氢,反应的离子方程式为:2H++2NO3-+3H2S→2NO↑+3S↓+4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写与判断,题目难度中等,明确FeS'、CuS的性质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
15.某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.某课外活动小组为确定反应后的废液组成,进行如下实验:(1)取100.00mL反应后的废液加入足量的AgNO3溶液,生成沉淀12.915g.(2)另取100.00mL反应后的废液加入过量铜片充分反应,铜片质量减少了0.32g.下列关于反应后的废液组成判断正确的是( )
| A. | 只含有Fe2+、Cu2+、Clˉ,不含有Fe3+ | B. | c(Fe2+):c(Cu2+)=1:1 | ||
| C. | c(Fe3+):c(Fe2+)=1:3 | D. | c(Clˉ)=0.9mol/L,c(Fe3+)=0.1mol/L |
2.物质的性质决定其用途,下列应用中利用了物质氧化性的是( )
| A. | 氧化铝做耐火材料 | B. | 纯碱去油污 | ||
| C. | 食醋除水垢 | D. | 漂白粉漂白织物 |
19.对下列说法的解释正确的是( )
| A. | 钢铁发生吸氧或析氢腐蚀时,铁均作负极反应被氧化:Fe-3e-═Fe3+ | |
| B. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 草木灰与铵态氮肥不能混用的原因:2NH4++CO32-═2NH3↑+CO2↑+H2O | |
| D. | 不能用浓H2SO4干燥H2S气体的原因:H2SO4(浓)+H2S═SO2↑+S↓+2H2O |
16.下图所示的实验操作与方法正确的是( )
| A. |  检验装置气密性 | B. |  过滤 | C. |  点燃酒精灯 | D. |  称量氯化钠 |
17.KHSO4在水溶液中能够电离出H+、K+和SO42-.下列对于KHSO4的分类中不正确的是( )
| A. | KHSO4是盐 | B. | KHSO4是酸式盐 | C. | KHSO4是钾盐 | D. | KHSO4是酸 |
 工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.
工业制得的纯碱中往往含有氯化钠杂质,为测定含NaC1杂质的样品中Na2CO3的质量分数,.他们采用如图所示装置,把一定质量的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积.
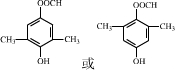 .
. .
. .化合物
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以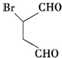 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下: