题目内容
6.C是一种常见塑料,通常具有一定的毒性,不能用于包装熟食;D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
(1)写出A的电子式
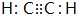 ;D的空间构型为平面结构,键角为120°;
;D的空间构型为平面结构,键角为120°;(2)写出碳化钙与水反应制取A的化学方程式CaC2+2H2O→Ca(OH)2+HC≡CH↑;苯和液溴反应生成E的化学方程式
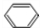 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$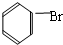 +HBr,其反应类型为取代反应.
+HBr,其反应类型为取代反应.(3)B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$
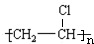 ,其反应类型为加聚反应.
,其反应类型为加聚反应.
分析 碳化钙与水反应生成气体A为HC≡CH,D是一种植物生长调节剂,用它可以催熟果实,则D为乙烯,乙炔与氢气发生加成反应得到乙烯,乙炔与HCl发生加成反应生成B,B发生加聚反应得到C,则B为CH2=CHCl,C为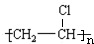 ,苯与液溴在催化剂条件下发生取代反应生成E为
,苯与液溴在催化剂条件下发生取代反应生成E为 ,据此解答.
,据此解答.
解答 解:碳化钙与水反应生成气体A为HC≡CH,D是一种植物生长调节剂,用它可以催熟果实,则D为乙烯,乙炔与氢气发生加成反应得到乙烯,乙炔与HCl发生加成反应生成B,B发生加聚反应得到C,则B为CH2=CHCl,C为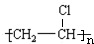 ,苯与液溴在催化剂条件下发生取代反应生成E为
,苯与液溴在催化剂条件下发生取代反应生成E为 .
.
(1)由上述分析可知,A为乙炔,电子式为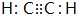 ;D为乙烯,C原子采取sp2杂化,键角约为120°,
;D为乙烯,C原子采取sp2杂化,键角约为120°,
故答案为: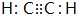 ;120°;
;120°;
(2)碳化钙与水反应制取乙炔的化学方程式为:CaC2+2H2O→Ca(OH)2+HC≡CH↑,
苯和液溴反应生成E的化学方程式: +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应,
+HBr,属于取代反应,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr;取代反应;
+HBr;取代反应;
(3)B→C是氯乙烯发生加聚反应生成聚氯乙烯,反应化学方程式为:nCH2=CHCl$\stackrel{催化剂}{→}$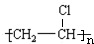 ,属于加聚反应,
,属于加聚反应,
故答案为:nCH2=CHCl$\stackrel{催化剂}{→}$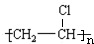 ;加聚反应.
;加聚反应.
点评 本题考查有机物推断,需要学生熟练掌握有机物的性质与转化,题目基础性强,贴近教材,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.关于同温同压下等体积的CO2和SO2两种气体,下列叙述中正确的是( )
(1)质量相等 (2)密度相等 (3)所含分子数相等 (4)所含电子数相等.
(1)质量相等 (2)密度相等 (3)所含分子数相等 (4)所含电子数相等.
| A. | (1)(2)(3)(4) | B. | (2)(3)(4) | C. | (3)(4) | D. | (3) |
17.分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
| A. | H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物 | |
| B. | HClO、H2SO4(浓)、HNO3均具有氧化性,都是氧化性酸 | |
| C. | HF、HClO、NH3都易溶于水,都是电解质 | |
| D. | C2H2、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸 |
14.只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区分开,该试剂可以是( )
| A. | 酸性高锰酸钾溶液 | B. | 溴化钾溶液 | ||
| C. | 溴水 | D. | 硝酸银溶液 |
1.下列晶胞所对应的化学式正确的是( )


| A. | A3B4 | B. | CD | C. | EF3G2 | D. | H5I |
11.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”),升高温度,逆反应速率增大(填“增大”、“减小”或“不变”)
(3)温度不变,减小CO浓度,平衡向正反应方向移动(填“正反应”或“逆反应”),该反应平衡常数K 值不变(填“增大”、“减小”或“不变”)
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=1mol•L-1,c(H2O)=3mol•L-1,c(CO2)=1mol•L-1,c(H2)=5mol•L-1,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(5)t℃时,在2L的固定容积的密闭容器中放入4mol CO2和6mol H2,平衡后CO2的转化率为60%,则达到平衡时CO的体积分数为24%,反应温度t为830℃.
温度不变,若起始时投入3.6mol CO、3.6mol H2O和1.8mol H2,则达到平衡时CO的体积分数为24%,H2的平衡浓度为1.62mol/L.
| T/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式K=$\frac{c(CO)•c(H{\;}_{2}O)}{c(CO{\;}_{2})•c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”),升高温度,逆反应速率增大(填“增大”、“减小”或“不变”)
(3)温度不变,减小CO浓度,平衡向正反应方向移动(填“正反应”或“逆反应”),该反应平衡常数K 值不变(填“增大”、“减小”或“不变”)
(4)800℃时,固定容积的密闭容器中放入混合物,起始浓度为c(CO)=1mol•L-1,c(H2O)=3mol•L-1,c(CO2)=1mol•L-1,c(H2)=5mol•L-1,则反应开始时,H2O的消耗速率比生成速率小(填“大”、“小”或“不能确定”)
(5)t℃时,在2L的固定容积的密闭容器中放入4mol CO2和6mol H2,平衡后CO2的转化率为60%,则达到平衡时CO的体积分数为24%,反应温度t为830℃.
温度不变,若起始时投入3.6mol CO、3.6mol H2O和1.8mol H2,则达到平衡时CO的体积分数为24%,H2的平衡浓度为1.62mol/L.
18.环境保护是当今社会的热门话题,地球上的能源主要源于太阳,绿色植物的光合作用可以大量吸收CO2以减缓温室效应,主要过程可以用下列三步来描述:
①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
下面关于绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式正确的是( )
①H2O(l)═2H+(aq)+$\frac{1}{2}$O2(g)+2e-△H=+284kJ•mol-1
②CO2(g)+C5(s)+2H+(aq)═2C3+(s)+H2O(l)+$\frac{1}{2}$O2(g)△H=+396kJ•mol-1
③12C3+(s)+12e-+6H2O(l)═C6H12O6(葡萄糖,s)+6C5(s)△H=-1200kJ•mol-1
下面关于绿色植物利用水和二氧化碳合成葡萄糖并放出氧气的热化学方程式正确的是( )
| A. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1880 kJ•mol-1 | |
| B. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2880 kJ•mol-1 | |
| C. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=+2560 kJ•mol-1 | |
| D. | 6CO2(g)+6H2O(l)═C6H12O6(葡萄糖,s)+6O2(g)△H=-1720 kJ•mol-1 |
15.水制取H2的常见原料,下列有关水的说法正确的是( )
| A. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| B. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| C. | 水分子间通过H-O键形成冰晶体 | |
| D. | 冰晶胞中水分子的空间排列方式与干冰胞类似 |
 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I-3(aq).I2、KI混合溶液中,I-3的物质的量浓度c(I-3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下到说法正确的组合是( )