��Ŀ����
��.������㶨���ܱ������У�����2mol CO2��5mol H2��һ�������·�����Ӧ�� CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
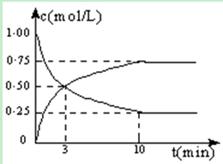
��1���ӷ�Ӧ��ʼ����10min��H2��ת����Ϊ ���� �������£���Ӧ��ƽ�ⳣ��K= �������ijһʱ�̱����¶Ȳ��䣬ֻ�ı�Ũ�ȣ�ʹc(CO2)=1.00mol/L��c(H2)=0.40mol/L��c(CH3OH)=c(H2O)=0.80mol/L����ƽ�� ��ѡ����ţ���
a���������ƶ� b���������ƶ�
c�����ƶ� d����ȷ��ƽ���ƶ�����
��2�����д�ʩ����ʹn(CH3OH)/n(CO2)������� ��ѡ����ţ���
a�������¶� b������He(g)��ʹ��ϵѹǿ����
c����H2O(g)����ϵ�з��� d���ٳ���l mol CH3OH(g)
II������̼����ȼ�ϵ�أ�MCFS����������1889�ꡣ����һ��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650�棬�ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1:1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ����ش��������⣺
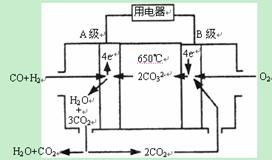
��1��A�缫�ĵ缫��Ӧ����ʽΪ ��
��2�������£���ʯī���缫���Դ˵�Դ���һ������CuSO4 ��Һ�����������������������ͬʱֹͣͨ�磬��������Һ�����Ϊ2L����Һ��pH=1��������ˮ�������H+������������������������ʵ����� ��
 CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g) + H2O(g) ��H =" -49.0" kJ/mol�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
��1���ӷ�Ӧ��ʼ����10min��H2��ת����Ϊ ���� �������£���Ӧ��ƽ�ⳣ��K= �������ijһʱ�̱����¶Ȳ��䣬ֻ�ı�Ũ�ȣ�ʹc(CO2)=1.00mol/L��c(H2)=0.40mol/L��c(CH3OH)=c(H2O)=0.80mol/L����ƽ�� ��ѡ����ţ���
a���������ƶ� b���������ƶ�
c�����ƶ� d����ȷ��ƽ���ƶ�����
��2�����д�ʩ����ʹn(CH3OH)/n(CO2)������� ��ѡ����ţ���
a�������¶� b������He(g)��ʹ��ϵѹǿ����
c����H2O(g)����ϵ�з��� d���ٳ���l mol CH3OH(g)
II������̼����ȼ�ϵ�أ�MCFS����������1889�ꡣ����һ��̼����ȼ�ϵ�أ���һ������Li2CO3��Na2CO3���ۻ����Ϊ����ʣ������¶�Ϊ650�棬�ڴ��¶�������Ϊ��������ú����CO��H2�������Ϊ1:1��ֱ����ȼ�ϣ��乤��ԭ����ͼ��ʾ����ش��������⣺

��1��A�缫�ĵ缫��Ӧ����ʽΪ ��
��2�������£���ʯī���缫���Դ˵�Դ���һ������CuSO4 ��Һ�����������������������ͬʱֹͣͨ�磬��������Һ�����Ϊ2L����Һ��pH=1��������ˮ�������H+������������������������ʵ����� ��
��.��1�� 90% �� K=" 144" �� a ��2�� c d
II����1�� CO+H2-4e-+2CO32-=3CO2+H2O ��2�� 0.1mol
�����������.��ͼ���ж�CO2��Ũ�Ƚ��ͣ�CH3OH(g)��Ũ�����ߣ� ���������Ϊ2L
CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g) ʼ�� 2 5 0 0
ת���� 1.5 4.5 1.5 1.5
ƽ���� 0.5 0.5 1.5 1.5
H2��ת����Ϊ4.5��5=0.9
K=1.5/2��1.5/2�£�0.5/2 ��(0.5/2)3��=144
Qc=0.80��0.80�£�1.00��0.403��=10��144����ƽ�������ƶ���
��2��a�����¶�ƽ�������ƶ�����ֵ��С������b�����³���He(g)��ƽ�ⲻ�ƶ�����ֵ���䣬����c��������ƽ�������ƶ�����ֵ�����ȷ��d�ٳ���CH3OH(g)���京����ߣ���ֵ�����ȷ��
II����1��A�缫Ϊ������ע�����Ϊ̼���Σ� CO+H2-4e-+2CO32-=3CO2+H2O ��
��2�����CuSO4 ��Һ�����������������������Ȳ���ͭ���ʣ��������������ӦʽΪ
������4OH- + 4e- = O2��+ 2H2O
������Cu2+ + 2e- = Cu(��)
2H+ + 2e- = H2������
�����������������ȣ����ݵ����غ���ʽΪ4n-2n=0.1��2[����������H+ ��ȥ�������ĵ�H+ ������Һ��ʣ��H+ ] n=0.1mol

��ϰ��ϵ�д�
�����Ŀ
 2NH3(g) ��H��0ƽ�����淴Ӧ�����ƶ�����
2NH3(g) ��H��0ƽ�����淴Ӧ�����ƶ����� 2C(g) + xD(g) ����ƽ��ʱ������2 mol C��D��Ũ��Ϊ0��5 mol��L��1�������ж���ȷ���ǣ� ��
2C(g) + xD(g) ����ƽ��ʱ������2 mol C��D��Ũ��Ϊ0��5 mol��L��1�������ж���ȷ���ǣ� �� 2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ����
2NH3������ƽ����ϵ�и����ʵ�Ũ�ȶ����ӵ�ԭ����2����������Ľ���� CH3OCH3(g)��CO2(g) ��H<0
CH3OCH3(g)��CO2(g) ��H<0
 [N(CH3)4]2S2O6(s)��H��0 ����[N(CH3)4]2SO4(s)����SO2����������Ϊ
[N(CH3)4]2S2O6(s)��H��0 ����[N(CH3)4]2SO4(s)����SO2����������Ϊ 2CO(g)����H��0
2CO(g)����H��0
 2NH3(g)����Ӧ�ﵽƽ��ı������������ٴδﵽƽ�⣬NH3Ũ����ԭƽ�ⲻͬ����
2NH3(g)����Ӧ�ﵽƽ��ı������������ٴδﵽƽ�⣬NH3Ũ����ԭƽ�ⲻͬ����