题目内容
工业上用电解法制备铝单质,
(1)写出反应方程式.
(2)当产生标准状况下氧气22.4L时,反应转移了多少摩尔电子?消耗氧化铝多少克?
(1)写出反应方程式.
(2)当产生标准状况下氧气22.4L时,反应转移了多少摩尔电子?消耗氧化铝多少克?
考点:电解原理
专题:电化学专题
分析:(1)电解氧化铝生成金属铝和氧气;
(2)根据电解方程式结合元素化合价的升降确定电子转移的情况以及消耗的氧化铝的质量.
(2)根据电解方程式结合元素化合价的升降确定电子转移的情况以及消耗的氧化铝的质量.
解答:
解:(1)电解氧化铝生成金属铝和氧气,方程式为:2Al2O3
4Al+3O2↑,答:反应方程式为2Al2O3
4Al+3O2↑;
(2)当产生标准状况下氧气22.4L即1mol时,设:消耗氧化铝物质的量是x,则
2Al2O3
4Al+3O2↑
2 3
x 1
x=
mol,所以消耗氧化铝的质量是
mol×27g/mol=18g,当生成3mol氧气,伴随12mol电子转移,所以产生标准状况下氧气22.4L即1mol时反应转移了4mol电子.
答:反应转移了4mol电子,消耗氧化铝18g.
| ||
| ||
(2)当产生标准状况下氧气22.4L即1mol时,设:消耗氧化铝物质的量是x,则
2Al2O3
| ||
2 3
x 1
x=
| 2 |
| 3 |
| 2 |
| 3 |
答:反应转移了4mol电子,消耗氧化铝18g.
点评:本题以电解氧化铝为载体考查了金属的冶炼及离子放电顺序,明确方程式的计算是解本题关键,根据电极反应来分析解答.

练习册系列答案
相关题目
含有C=C的有机物与O3作用形成不稳定的臭氧化物,臭氧化物在还原剂存在下,与水作用分解为羰基化合物,总反应为:
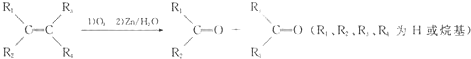
一以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是( )

一以下四种物质发生上述反应,所得产物为纯净物且能发生银镜反应的是( )
| A、(CH3)2═C(CH3)2 |
| B、2-氯-2-丁烯 |
C、 |
D、 |
常温下,0.1mol/LHA溶液的pH>1,0.1mol/LBaOH溶液中c(OH-):c(H+)=1012,将这两种溶液等体积混合,以下离子浓度关系判断正确的是( )
| A、c(H+)<c(OH-)<c(A-)<c(B+) |
| B、c(OH-)<c(H+)<c(B+)<c(A-) |
| C、c(A-)=c(B+)>c(H+)=c(OH-) |
| D、c(A-)=c(B+)<c(H+)=c(OH-) |
加入下列物质,能使水的电离平衡向正方向移动的是( )
| A、浓氨水 |
| B、浓盐酸 |
| C、NH4Cl固体 |
| D、NaCl固体 |
下列关于物质性质的叙述中,正确的是( )
| A、SO2的水溶液具有酸性、氧化性、还原性和漂白性 |
| B、石灰水、高岭石、石英和水晶的主要成分都是硅酸盐 |
| C、过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe2+ |
| D、硅是应用广泛的半导体材料,常温下易于氧气、氯气、硫酸等物质反应 |
 某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH
某有机物A,由C、H、O三种元素组成,在一定条件下,有以下转变关系:(R-CH2CH2OH